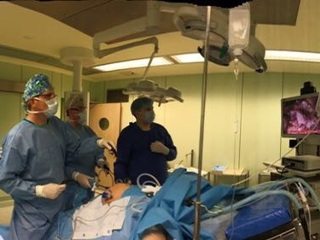
В статье представлен первый опыт реконструктивной операции по поводу постгастрорезекционного синдрома – реконструкции по Ру, выполненной лапароскопическим доступом. The first experience of reconstructive operation for a postgastrectomy syndrome – Roux-en-Y-reconstruction executed by laparoscopic access is presented in article.
Лапароскопическая резекция культи желудка с реконструкцией по Ру. Первый опыт применения лапароскопических технологий в коррекции постгастрорезекционного синдрома.
Евсеев М.А., Владыкин А.Л., Головин Р.А., Дынников А.В.
Laparoscopic resection of gastric stump with Roux-en-Y-reconstruction. First experience of laparoscopic technologies in treatment of postgastrectomy syndrome.
Evseev M., Vladykin A., Golovin R., Dynnikov A.
Актуальность.
На сегодняшний день дистальная резекция желудка является стандартизированной лечебной процедурой с предсказуемыми и, в подавляющем большинстве случаев, благоприятными непосредственными и отдаленными результатами. Тем не менее, как столетие назад, так и сейчас, термины «болезни оперированного желудка» и «постгастрорезекционный синдром» имеют полное право на существование в клинике, поскольку обобщенные этими терминами диспептические расстройства встречаются по разным оценкам у 10 – 25% пациентов, перенесших резекцию желудка или гастрэктомию [1-8]. При этом по-прежнему принято считать, что наиболее часто болезни оперированного желудка возникают у пациентов, подвергнутых различным модификациям дистальной резекции желудка по методу Бильрот-II [1,3,5,7,9-13].
Традиционно постгастрорезекционные синдромы разделяют на функциональные и органические. Вполне очевидно, что если функциональные нарушения по определению могут и должны быть корригированы консервативными мероприятиями, то органические нарушения способны быть нивелированы только с помощью хирургического пособия. Наиболее частые органические нарушения в группе болезней оперированного желудка – синдром приводящей петли и пептические язвы гастро-энтероанастомоза – хорошо известны по-своему этиопатогенезу, клиническим проявлениям, методикам хирургического лечения и по возможным способам профилактики при первичной операции. Последнее обстоятельство особенно интересно, поскольку пациенты с указанными синдромами по-прежнему появляются в хирургических клиниках, нередко по прошествии нескольких месяцев или даже лет упорного лечения у гастроэнтерологов. И по-прежнему при повторных вмешательствах становятся очевидными характерные особенности первичной операции в виде недостаточного объема резекции желудка (антрумрезекция или гемигастрэктомия) и/или проведенного реконструктивного этапа (неправильно выбранные длина и расположение приводящих и отводящих петель тонкой кишки, размер и ориентация анастомоза и т.д.). В этой связи приходится признать правоту авторов, категорично утверждающих, что причиной постгастрорезекционных синдромов органической природы являются исключительно технические дефекты, имевшие место при выполнении первичной резекции желудка [1,3,4,5,7,8,13-15].
Для оперативной коррекции постгастрорезеционного синдрома за несколько десятилетий развития хирургической гастроэнтерологии было предложено и апробировано не менее нескольких десятков различных методик реконструктивных вмешательств. Тем не менее, на сегодняшний день практически все авторы единодушны в том, что практически единственной приемлемой методикой повторного вмешательства по поводу болезней оперированного желудка является реконструкция пищеварительной трубки по Ру (Roux). Формирование билио-панкреатической и алиментарной кишечных петель, соединенных по типу Roux-en-Y, исключает рефлюксы пищеварительных соков и химуса, препятствует быстрому опорожнению культи желудка и ускоренному пассажу химуса, что определяет возможность быстрой компенсации имевшихся постгастрорезекционных расстройств пищеварения после проведения реконструкции по Ру [1,3,4,8,10,12-14,16-18]. Хорошо известно, что антирефлюксные свойства билио-панкреатической петли, в том числе в плане ликвидации дуоденальной гипертензии, проявляются при ее длине не менее 50 см. Аналогично антирефлюксные свойства алиментарной петли и, соответственно, профилактика рефлюкс-гастрита и эзофагита обеспечиваются длиной последней не менее 40 см [1,2,5,8,12,14,17].
Известным негативным моментом резекции по Ру является потенциальная возможность возникновения Ру-стаз-синдрома. В настоящее время принято считать, что ведущую роль в патогенезе данного синдрома играет пересечение волокон интрамуральных нервных сплетений первой петли тонкой кишки, приводящее к нарушению распространения активирующего влияния дуоденального пейсмекера на тонкую кишку и возникновению ее пареза. Несмотря на то, что при первичных резекциях желудка по Ру доказанное возникновение Ру-стаз-синдрома выявлено не более чем у 8% пациентов, данное обстоятельство формально дало повод к утолению хирургического тщеславия внедрением «новой» методики так называемой «uncut Roux-en-Y» - резекции желудка по Ру без пересечения тонкой кишки [6,15]. Не можем не заметить в этой связи, что для сохранения исторических приоритетов все-таки имеет смысл сопоставить эту «новую» технику uncut Roux-en-Y и ставший уже академическим способ реконструкции по Бильрот-II в модификации Braun-Balfour с заглушкой на приводящей петле по А.А. Шалимову [3]. В проведенных сравнительных исследованиях показана более быстрая эвакуация из культи желудка после uncut Roux-en-Y, чем после стандартной резекции по Ру, не влекущая за собой, однако, значимого улучшения отдаленных результатов оперативного лечения.
Уже более четверти века прошло с момента внедрения в хирургическую гастроэнтерологию технологий лапароскопического доступа. В наше время абсолютно стандартными являются ушивание перфоративных язв, фундопликации, парциальные, продольные, дистальные резекции желудка, гастрэктомии, регионарные лимфаденэктомии, выполненные с применением лапароскопических технологий. В отдельных сообщениях описаны реконструктивные лапароскопические операции после ранее выполненных бариатрических вмешательств и лапароскопические операции, проведенные после постгастрорезекционных осложнений ближайшего послеоперационного периода [6,7,21]. Тем не менее, сообщения о повторных реконструктивных операциях по поводу постгастрорезекционного синдрома, проведенных лапароскопически, в доступной литературе (PubMed, e-LIBRARY) отсутствуют. В этой связи мы посчитали возможным поделиться своим первым опытом реконструктивной операции, выполненной по поводу постгастрорезекционного синдрома лапароскопическим доступом.
Клиническое наблюдение.
Пациент Александр П., 67 лет, поступил в Отделение абдоминальной хирургии ФГБУ «Клиническая больница №1 (Волынская)» УДП РФ 17 апреля 2018 года в срочном порядке с клинической картиной рецидивирующего желудочного кровотечения: периодическая (один раз в 2-3 дня) рвота содержимым типа «кофейной гущи», неоднократные эпизоды мелены. Помимо жалоб на общую слабость и головокружение, пациент указывал на возможность принятия только жидкой пищи в малых количествах. Употребление полужидкой пищи в стандартном объеме ограничивалось неизбежным появлением дискомфорта, ощущения тяжести и болей в эпигастрии после еды, сопровождавшихся отрыжкой и периодической рвотой съеденной пищей. Прием спазмолитиков и анальгетиков существенного облегчения страданий не приносил.
Из анамнеза известно, что около двадцати лет назад пациент перенес дистальную резекцию желудка по поводу кровоточащей язвы. Тип выполненного оперативного вмешательства по причине утери медицинской документации неизвестен. После проведенной операции пациент неукоснительно придерживался рекомендованной диеты. Тем не менее, спустя год после вмешательства пациент начал отмечать появление дискомфорта и тяжести в эпигастрии после еды, с течением времени дополнившихся периодическими болями в эпигастрии, отрыжкой и рвотой съеденной пищей. Указанные явления послужили причиной не только изменения режима питания пациента (частое дробное питание только жидкой пищей в малых количествах), но и изменения места жительства: пациент был вынужден проводить большую часть времени в регионе Кавказских минеральных вод, поскольку субъективно использование лечебных и столовых минеральных вод оказывало значительное уменьшение явлений диспепсии. Появление рвоты содержимым типа «кофейной гущи» и эпизодов мелены пациент отметил за две недели до настоящей госпитализации.
При первичном осмотре состояние пациента было расценено как среднетяжелое (АРАСНЕ II 12 баллов). Пациент сниженного питания, ИМТ 16,7 кг/м², астенизирован. Показатели внешнего дыхания и гемодинамики находились в пределах референсных значений. При физикальном исследовании живота определяется рубец после верхне-срединной лапаротомии без формирования грыжи, объемные образования пальпаторно не определяются. При ректальном исследовании - следы мелены. Лабораторно – гемоглобин 82 г/л, лейкоциты 9,1х109, общий белок 51 г/л, альбумин 29 г/л.
При экстренной эзофагогастродуоденоскопии выявлена картина оперированного по Бильрот-II желудка с культей желудка средних размеров, проходимым гастро-энтероанастомозом и наличием приводящего (содержит желчь) расширенного и отводящего спавшегося сегментов тонкой кишки. Слизистая культи желудка с явлениями острого воспаления и множественными мелкими эрозиями. В отводящем сегменте тонкой кишки в 0,5 см от линии анастомоза определяются две острые язвы до 0,5 см в диаметре с фиксированными сгустками крови в их дне (Forrest IIB). Проведен превентивный эндогемостаз аргоно-плазменной коагуляцией. В отводящий сегмент тонкой кишки установлен назо-интестинальный питательный зонд.
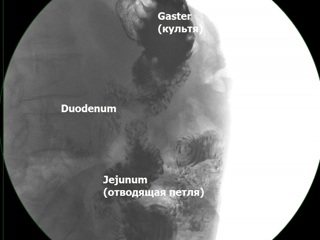
При рентгенологическом исследовании желудка с контрастированием бариевой взвесью определяется культя желудка, оперированного по Бильрот-II в модификации Гофмейстера-Финстерера, соответствующая по своим размерам проведенной гемигастрэктомии. Контраст практически без депонирования в желудке поступает в расширенную приводящую петлю тонкой кишки, а из нее – в дилатированную до 5 см двенадцатиперстную кишку. Длина приводящей к гастро-энтероанастомозу тонкокишечной петли составляет 12 см. При полном заполнении приводящей петли и двенадцатиперстной кишки отмечается рефлюкс контраста в желудок и отсроченная эвакуация в отводящую петлю тонкой кишки.
На основании проведенного обследования клинический диагноз был сформулирован следующим образом: К91.1. Синдром оперированного желудка (состояние после дистальной резекции желудка по Бильрот-II в модификации Гофмейстера-Финстерера от 1998 года). Пептические язвы гастро-энтероанастомоза, осложненные рецидивирующим кровотечением. Синдром приводящей петли. Хронический панкреатит. Хроническая постгеморрагическая анемия. Синдром нутритивной недостаточности. Состояние после превентивного эндогемостаза по поводу кровотечения из язв гастро-энтероанастомоза Forrest IIB.
С учетом очевидной бесперспективности консервативной коррекции диспепсии, обусловленной синдромом приводящей петли, и сохраняющейся угрозы рецидива кровотечения из язв гастро-энтероанастомоза были установлены показания к проведению срочного оперативного вмешательства. Предполагаемый объем вмешательства – резекция культи желудка с реконструкцией по Ру (Roux-en-Y). С учетом наличия у пациента ультракороткой приводящей петли для адекватной декомпрессии двенадцатиперстной кишки и предотвращения еюно-дуоденального рефлюкса было решено удлинить билио-панкреатическую петлю пятидесятисантиметровой тонкокишечной вставкой с последующим формированием собственно Y-образного анастомоза между билио-панкреатической и алиментарной петлями тонкой кишки. Накопленный в Отделении абдоминальной хирургии опыт лапароскопических операций на желудке (фундопликация, дистальная резекция желудка, гастрэктомия, продольная резекция желудка) сделал обоснованным решение о выполнении оперативного вмешательства лапароскопическим доступом. Принимая во внимание наличие у пациента синдрома нутритивной недостаточности алиментарного генеза, вмешательство было решено отложить на срок, необходимый для интенсивной коррекции нутритивного статуса.
Нутритивная поддержка включала в себя введение в назо-интестинальный зонд сбалансированных энтеральных смесей Nutricomp®Energy и парентеральное питание системой «три в одном» Nutriflex Lipid® 70/180. Общий суточный калораж проводимого питания составлял 3450 ккал/сут, количество вводимого белка – 90 г/сут. Параллельно проводились однократная трансфузия эритроцитарной массы, компенсация водно-электролитных нарушений, продленная инфузия эзомепразола в дозе 160 мг/сут. В течение пяти суток предоперационной подготовки клинико-лабораторных признаков рецидива кровотечения отмечено не было. Лабораторные показатели в исходе предоперационной подготовки формально характеризовали компенсацию нутритивного статуса пациента: гемоглобин 112 г/л, лейкоциты 6,1х109, общий белок 71 г/л, альбумин 39 г/л.
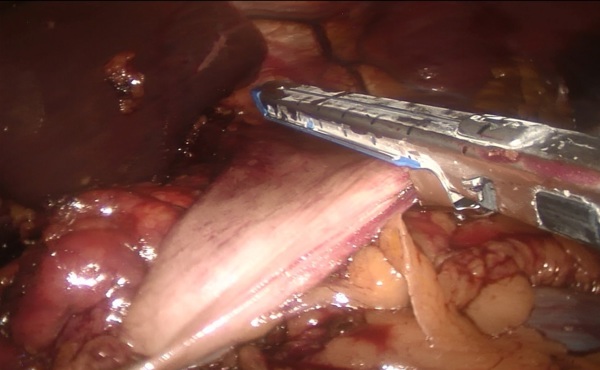
Пациент оперирован на шестые сутки с момента госпитализации под комбинированным эндотрахеальным наркозом с эпидуральной анестезией. Оперативное вмешательство проведено в запланированном объеме: лапароскопическая резекция культи желудка с реконструкцией по Ру и удлинением билио-панкреатической петли изоперистальтическим тонкокишечным сегментом.
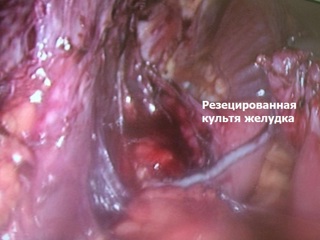
В брюшную полость введены шесть троакаров: в параумбиликальной области, три 5-мм троакара в подреберьях и костальном углу, два 12-мм троакара в боковых областях. При ревизии: в верхнем этаже брюшной полости - массивный рубцово-спаечный процесс с вовлечением париетальной брюшины передней брюшной стенки, большого сальника, поперечно-ободочной кишки и мезоколон, висцеральной и диафрагмальной поверхностей левой доли печени, культи желудка. С помощью диссектора Harmonic® и коагулятора LigaSure® произведен адгезиолизис, поэтапно выделены из спаек и рубцов поперечно-ободочная кишка, мезоколон, висцеральная поверхность левой доли печени, передняя и задняя стенки культи желудка (культя желудка соответствует выполненной ранее гемигастрэктомии). Установлено, что реконструктивный этап первичной операции был выполнен по методике Гофмейстера-Финстерера на ультракороткой (до 12 см) приводящей петле, проведенной позадиободочно. С учетом предоперационного обследования и операционной находки (ультракороткая приводящая петля) решение об объеме оперативного пособия соответствовало предоперационной концепции: резекция культи желудка по Ру с удлинением билио-панкреатической петли сегментом тонкой кишки, расположенным изоперистальтически.
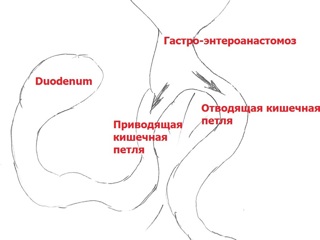
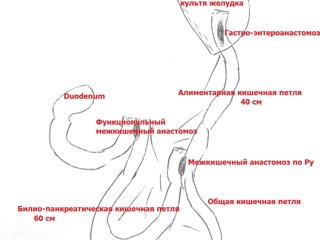
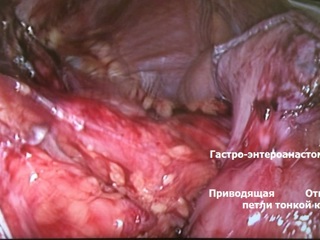
Зона гастроэнтероанастомоза с предлежащими петлями тонкой кишки выделена из ткани мезоколон; культя желудка мобилизована по передней и задней стенкам, малой и большой кривизне до уровня субтотальной резекции (субкардия – ворота селезенки). Желудок пересечен по уровню мобилизации с использованием аппарата EchelonFlex®60. Произведено формирование функционального анастомоза "бок в бок" между приводящей и отводящими петлями тонкой кишки с одномоментным пересечением приводящей петли тонкой кишки в 2 см проксимальнее, а отводящей петли – в 6 см дистальнее гастроэнтероанастомоза аппаратом EchelonFlex®60. Операционный препарат – дистальная часть культи желудка с участком приводящей и участком отводящей тонкой кишки – помещен в контейнер. В 50 см дистальнее сформированного функционального анастомоза тонкая кишка пересечена аппаратом EchelonFlex®60. Таким образом при пересечении тонкой кишки были сформированы билио-панкреатическая и алиментарная петли. Алиментарная петля тонкой кишки проведена к культе желудка позадиободочно через уже имевшееся окно в мезоколон. На алиментарной петле сформирован задний продольный гастро-энтероанастомоз «бок в бок» аппаратом EchelonFlex®60. В 40 см дистальнее гастро-энтероанастомоза алиментарная петля соединена с билио-панкреатической петлей (Y-образная реконструкция по Ру) формированием межкишечного анастомоза «бок в бок» аппаратом EndoGia®45. Технологические отверстия анастомозов ушиты непрерывным швом нитью Biosyn 3/0; анастомозы герметичны. Через левосторонний трансректальный минилапаротомный доступ операционный препарат удален в контейнере; под левую долю печени через троакарную рану в правом подреберье установлен трубчатый дренаж.
Продолжительность оперативного вмешательства составила 3 часа 10 минут; общая кровопотеря – до 100 мл. Пациент экструбирован на операционном столе и переведен в отделение хирургической реанимации на самостоятельном дыхании.
Ранний послеоперационный период у пациента П. проходил по программе ускоренной послеоперационной реабилитации. Физическая активизация пациента и пероральный прием воды малыми порциями начаты через 6 часов после вмешательства.
Проводился послеоперационный мониторинг перистальтической активности на селективном полиграфе ЖКТ с возможностью проведения коррекции моторно-эвакуаторных нарушений методом транскутанной резонансной стимуляции (патент РФ 2648819). На селективном полиграфе ЖКТ кривая перистальтической активности приняла физиологический ритм с приростом амплитуды до нормальных значений (14-18мкВ) с 4 часа после операции. На основании анализа кривых и собственного восстановления перистальтики было принято решение о нецелесообразности стимуляции электрофизиологическими методами.
Перистальтические шумы аускультативно начали определяться через 8 часов, отхождение газов началось через 20 часов, первый стул – через 36 часов после операции. На вторые сутки послеоперационного периода пациент переведен в хирургическое отделение на пролонгированной эпидуральной анальгезии, полностью восстановлена двигательная активность пациента при отсутствии болевых ощущений, удален дренаж из брюшной полости. Начат пероральный прием сбалансированных смесей для сипинга Nutricomp®Drink Plus на фоне продолжения парентерального питания системой «три в одном» Nutriflex Lipid® 70/180.
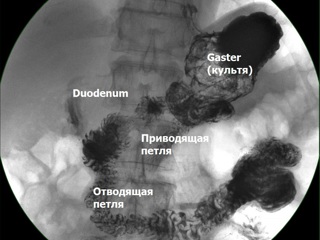
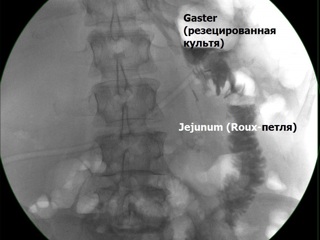
На третьи сутки послеоперационного периода выполнена контрольная рентгенография желудка с контрастированием бариевой взвесью. Определяется свободное прохождение контраста через пищевод, заполнение культи желудка, соответствующей объему субтотальной резекции, порционное своевременное поступление контраста через гастро-энтероанастомоз в тонкую кишку и дальнейший свободный пассаж контраста по ней. Рефлюкса контраста в билио-панкреатическую петлю не выявлено. С третьих суток послеоперационного периода пациентом начат прием пищи по варианту жидкой части щадящей диеты с дополнительным употреблением смесей для сипинга. Удален катетер для продленной эпидуральной анальгезии.
С учетом гладкого течения ближайшего послеоперационного периода, отсутствия болей и явлений диспепсии при употреблении жидкой и полужидкой пищи, пациент выписан для последующей амбулаторной реабилитации под наблюдение врача-гастроэнтеролога. На протяжении последующих трех месяцев проводился мониторинг состояния пациента еженедельно по телефону и в ходе трех плановых осмотров в клинике. Известно, что уже в первую неделю после выписки из стационара пациент совершил путешествие с авиаперелетом средней продолжительности. В течение последующих трех месяцев пациент отмечал возможность расширения пищевого рациона без явлений диспепсии, стойкую тенденцию к прибавке в весе, отсутствие необходимости в приеме каких бы то ни было лекарственных препаратов.
Заключение.
Приведенное клиническое наблюдение позволяет сделать ряд заключений. Прежде всего, данное наблюдение очередной раз подтверждает правомочность положения о том, что реконструкция пищеварительной трубки по Ру является оптимальным способом лечения пациентов с постгастрорезекционными синдромами, требующими хирургической коррекции – синдромом приводящей петли, пептическими язвами гастро-энтероанастомоза. Именно реконструкция с формированием билио-панкреатической и алиментарной кишечных петель, соединенных по типу Roux-en-Y, исключает рефлюксы пищеварительных соков, препятствует быстрому опорожнению культи желудка и ускоренному пассажу химуса. Данные обстоятельства, в свою очередь, определяют возможность быстрой компенсации имевшихся постгастрорезекционных расстройств пищеварения после проведения резекции культи желудка с реконструкцией по Ру. Действительно, уже в первую неделю послеоперационного периода пациент имел возможность полноценного питания в рамках лечебной диеты без малейших симптомов диспепсии. При этом у пациента не было отмечено ни клинических, ни рентгенологических признаков развития Ру-стаз-синдрома. Тощая кишка во время реконструктивной операции была пересечена всего в 10 см от дуодено-еюнального перехода, что по распространенному в зарубежной литературе мнению должно было привести к изоляции дуоденального пейсмекера кишечной перистальтики и практически облигатному возникновению пареза тонкой кишки с нарушением эвакуации из культи желудка. Тем не менее, клинически значимого и рентгенологически доказанного нарушения эвакуации из желудка после выполненного вмешательства выявлено не было, что указывает на безосновательность категорических утверждений ряда авторов о необходимости облигатного сохранения непрерывности интрамуральных нервных сплетений «новой» техникой uncut Roux-en-Y реконструкции. Дополнительный элемент проведенного оперативного вмешательства – удлинение билио-панкреатической петли изоперистальтической тонкокишечной вставкой – с одной стороны, полностью исключил возможность рецидива синдрома приводящей петли, а с другой, при закономерном снижении интрадуоденального давления создал предпосылки для разрешения явлений хронического панкреатита.
Приведенное наблюдение иллюстрирует техническую возможность выполнения повторных, в том числе и реконструктивных операций на желудке с применением лапароскопических технологий. В свою очередь малая травматичность лапароскопической операции сделала абсолютно реальным ведение пациента в рамках программы ускоренной послеоперационной реабилитации с ранней физической активизацией и с ранним началом перорального приёма пищевых субстанций. Помимо вышеприведенных нюансов хирургической техники и тактики данный клинический пример явился яркой иллюстрацией необходимости целенаправленной предоперационной и послеоперационной коррекции нутритивного статуса пациента. Очевидно, что компенсация исходно имевшихся нутритивных нарушений и последующего послеоперационного катаболизма во многом определили гладкое течение ближайшего послеоперационного периода. Успешный опыт проведения лапароскопической резекции культи желудка с реконструкцией по Ру стал для нашей клиники важной вехой освоения лапароскопических технологий в абдоминальной хирургии и закономерным основанием для продолжения разработок в области реконструктивно-восстановительной хирургии пищеварительного тракта.
№ | Литературы | Reference |
1 | Волков С.В. Патологические синдромы после гастрэктомии. Чебоксары, 1998. 208с. | Volkov S.V. Patologicheskiye sindromy posle gastrektomii. Cheboksary, 1998. 208p. (In Russian) |
2 | Петров В.П., Бадуров Б.Ш., Хабурзания А.К. Резекция желудка по Ру. М., ПИК ВИНИТИ, 1998, 212с. | Petrov V.P., Badurov B.SH., Khaburzaniya A.K. Rezektsiya zheludka po Ru. M., PIK VINITI, 1998, 212p (in Russian) |
3 | Шалимов А.А., Саенко В.Ф. Хирургия желудка и двенадцатиперстной кишки. Киев, 1972, 355 с. | Shalimov A.A., Sayenko V.F. Khirurgiya zheludka i dvenadtsatiperstnoy kishki. Kiyev, 1972, 355p. (in Russian) |
4 | Eagon JC, Miedema BW, Kelly KA. Postgastrectomy syndromes. Surg Clin North Am. 1992 Apr;72(2):445-65. | Eagon JC, Miedema BW, Kelly KA. Postgastrectomy syndromes. Surg Clin North Am. 1992 Apr;72(2):445-65. |
5 | Inokuchi M., Long-term outcomes of Roux-en-Y and Billroth-I reconstruction after laparoscopic distal gastrectomy. Gastric Cancer. 2013;16(1):67-73 | Inokuchi M., Long-term outcomes of Roux-en-Y and Billroth-I reconstruction after laparoscopic distal gastrectomy. Gastric Cancer. 2013;16(1):67-73 |
6 | Ma JJ. A modified uncut Roux-en-Y anastomosis in totally laparoscopic distal gastrectomy: preliminary results and initial experience. Surg Endosc. 2017;31(11):4749-4755. | Ma JJ. A modified uncut Roux-en-Y anastomosis in totally laparoscopic distal gastrectomy: preliminary results and initial experience. Surg Endosc. 2017;31(11):4749-4755. |
7 | Martin RF. Surgical management of ulcer diseases. Surg. Clin. N. Am. 2005;85:907-929. | Martin RF. Surgical management of ulcer diseases. Surg. Clin. N. Am. 2005;85:907-929. |
8 | Takahashi M., Terashima M., Kawahira H. Quality of life after total vs distal gastrectomy with Roux-en-Y reconstruction: Use of the Postgastrectomy Syndrome Assessment Scale-45. World J Gastroenterol. 2017; 23(11):2068-2076. | Takahashi M., Terashima M., Kawahira H. Quality of life after total vs distal gastrectomy with Roux-en-Y reconstruction: Use of the Postgastrectomy Syndrome Assessment Scale-45. World J Gastroenterol. 2017; 23(11):2068-2076. |
9 | Ablasmaier В., Gellert К., Tanzella U., Muller J.M. Laparoscopic Billroth-II gastrectomy. J Laparoendosc Surg. 1996.;6:319-324. | Ablasmaier В., Gellert К., Tanzella U., Muller J.M. Laparoscopic Billroth-II gastrectomy. J Laparoendosc Surg. 1996.;6:319-324. |
10 | Miwa K. Jejunal pouch interposition and distal gastrectomy. Nippon. Geka. Gakkaai. Zasshi. 1997;98(6):560-564. | Miwa K. Jejunal pouch interposition and distal gastrectomy. Nippon. Geka. Gakkaai. Zasshi. 1997;98(6):560-564. |
11 | Soper N.J., Brunt L.M., Brewer J.D., Meininger T.A. Laparoscopic Billroth II gastrectomy in the canine model. Surg Endosc. 1994;8:1395-1398. | Soper N.J., Brunt L.M., Brewer J.D., Meininger T.A. Laparoscopic Billroth II gastrectomy in the canine model. Surg Endosc. 1994;8:1395-1398. |
12 | Zang L. Reconstruction after laparoscopic assisted distal gastrectomy: technical tips and pitfalls. Transl Gastroenterol patol. 2017;21;2:66. | Zang L. Reconstruction after laparoscopic assisted distal gastrectomy: technical tips and pitfalls. Transl Gastroenterol patol. 2017;21;2:66. |
13 | Zornig C, Emmermann A, Blöchle C, Jäckle S. Laparoscopic 2/3 resection of the stomach with intracorporal Roux-en-Y anastomosis. Chirurg. 1998;69(4):467-700. | Zornig C, Emmermann A, Blöchle C, Jäckle S. Laparoscopic 2/3 resection of the stomach with intracorporal Roux-en-Y anastomosis. Chirurg. 1998;69(4):467-700. |
14 | Kawano F, Tashiro K, Nakao H, Fujii Y, Ikeda T, Takeno S, Nakamura K, Nanashima A. Jejunogastric intussusception after distal gastrectomy with Roux-en-Y reconstruction: A case report. Int J Surg Case Rep. 2018;44:105-109. doi: 10.1016/j.ijscr.2017.12.042 | Kawano F, Tashiro K, Nakao H, Fujii Y, Ikeda T, Takeno S, Nakamura K, Nanashima A. Jejunogastric intussusception after distal gastrectomy with Roux-en-Y reconstruction: A case report. Int J Surg Case Rep. 2018;44:105-109. doi: 10.1016/j.ijscr.2017.12.042 |
15 | Uyama I, Sakurai Y, Komori Y. Laparoscopy-assisted uncut Roux-en-Y operation after distal gastrectomy for gastric cancer. Gastric Cancer. 2005;8(4): 253-7. | Uyama I, Sakurai Y, Komori Y. Laparoscopy-assisted uncut Roux-en-Y operation after distal gastrectomy for gastric cancer. Gastric Cancer. 2005;8(4): 253-7. |
16 | Евсеев М.А., Фомин В.С., Владыкин А.Л., Клишин И.М., Никитин В.Е. Применение комплексного консервативного лечения пареза желудочно-кишечного тракта после оперативного вмешательства большого объема. Анналы хирургии. 2018;23(3):188-195. | Evseev MA, Fomin VS, Vladykin AL, Klishin IM, Nikitin V.Ye. The use of complex conservative treatment of paresis of the gastrointestinal tract after surgical intervention of large volume. Annaly khirurgii. 2018;23(3):188-195. (In Russian) |
17 | Tanaka T. Jejunal pouch length influences metabolism after total gastrectomy. Hepatogastroenterology. 1997;44(15):891-896. | Tanaka T. Jejunal pouch length influences metabolism after total gastrectomy. Hepatogastroenterology. 1997;44(15):891-896. |
18 | Yeon-Ju H, Joo-Ho L. The Advances of Laparoscopic Gastrectomy for Gastric Cancer. Gastroenterology Research and Practice. 2017;3:9278469. | Yeon-Ju H, Joo-Ho L. The Advances of Laparoscopic Gastrectomy for Gastric Cancer. Gastroenterology Research and Practice. 2017;3:9278469. |
19 | Dapri G, Cadière GB, Himpens J. Laparoscopic reconversion of Roux-en-Y gastric bypass to original anatomy: technique and preliminary outcomes. Obes Surg. 2011;21(8):1289-95. | Dapri G, Cadière GB, Himpens J. Laparoscopic reconversion of Roux-en-Y gastric bypass to original anatomy: technique and preliminary outcomes. Obes Surg. 2011;21(8):1289-95. |
20 | Dong Jin Kim, Wook Kim. Role of Laparoscopic Management for Postgastrectomy Complications. J Laparoendosc Adv Surg Tech A. 2018;28(4):402-407. doi: 10.1089/lap.2017.0541. | Dong Jin Kim, Wook Kim. Role of Laparoscopic Management for Postgastrectomy Complications. J Laparoendosc Adv Surg Tech A. 2018;28(4):402-407. doi: 10.1089/lap.2017.0541. |
21 | Zurita Mv LC, Tabari M, Hong D. Laparoscopic conversion of laparoscopic Roux-en-Y gastric bypass to laparoscopic sleeve gastrectomy for intractable dumping syndrome and excessive weight loss. Surg Obes Relat Dis. 2013;9(2): 34-7. | Zurita Mv LC, Tabari M, Hong D. Laparoscopic conversion of laparoscopic Roux-en-Y gastric bypass to laparoscopic sleeve gastrectomy for intractable dumping syndrome and excessive weight loss. Surg Obes Relat Dis. 2013;9(2): 34-7. |
19 июля 2018 г.
Ещё больше полезной информации на нашем Телеграм-канале