Общеизвестно, что в желудочно-кишечном тракте нестероидные противовоспалительные препараты (НПВП) токсичны не только для слизистой пищеварительной трубки, но и для печени. Иллюстрацией социальной значимости проблемы гепатотоксичности НПВП является включение в весьма ограниченный список показаний для трансплантации печени острой печеночной недостаточности, обусловленной приемом НПВП. Проблема гепатотоксического действия некоторых НПВП является настолько острой, что в ряде стран данные препараты законодательно к использованию не допущены. Так, например, НПВП нимесулид в настоящее время запрещен к использованию в Испании, Финляндии, Израиле, Индии, Шри-Ланке. В США, Великобритании, Канаде и Австралии препарат не допущен к регистрации. Удивительно в этой связи, что в России нимесулид используется и в педиатрической практике.
Все современные НПВП качественно обладают гепатотоксичностью, однако количественная степень негативного воздействия на печень у них весьма вариабельна. Наибольшим потенциалом в плане развития НПВП-индуцированной гепатотоксичности обладают сулиндак, нимесулид и индометацин. Наименьшей гепатотоксичностью обладают селективный ингибитор ЦОГ-2 целекоксиб (Целебрекс) и традиционный НПВП напроксен.
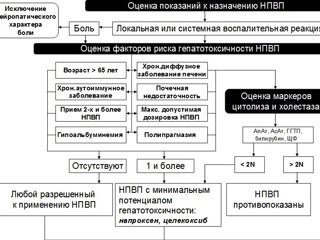
Как минимизировать риск токсических эффектов со стороны печени у пациентов, нуждающихся в терапии НПВП? Назначение НПВП с учетом их потенциальной гепатотоксичности может иметь характер алгоритма. На первом этапе, по аналогии с вышеописанным алгоритмом, проводится оценка показаний к назначению НПВП (локальная или системная воспалительная реакция). Затем проводится оценка факторов риска гепатотоксичности НПВП. При этом следует помнить, что гепатотоксическим потенциалом качественно обладают все современные НПВП. С другой стороны, количественный критерий гепатотоксичности позволяет разделить все НПВП на препараты с высоким гепатотоксическим потенциалом (сулиндак, ибупрофен, нимесулид) и препараты с низким гепатотоксическим потенциалом (напроксен, целекоксиб). Четкого временного промежутка между началом терапии НПВП и возникновением повреждения печеночной паренхимы до настоящего времени не установлено. Поэтому разделение терапии НПВП на непродолжительную и длительную с точки зрения реализации их гепатотоксического потенциала является некорректным: развитие цитолитического или холестатического синдрома возможно уже через несколько суток от начала терапии. К факторам риска гепатоксичности НПВП относятся: возраст пациента старше 65 лет, наличие аутоиммунного заболевания, почечной недостаточности, гипоальбуминемия, прием более одного НПВП или прием НПВП в максимальной дозе, одновременное назначение большого числа лекарственных препаратов и, наконец, самое существенное – наличие исходной патологии печени. Следует заметить, что само по себе наличие острой патологии печени с синдромами цитолиза или холестаза, тем более осложненное печеночноклеточной недостаточностью, должно являться противопоказанием к назначению НПВП. Возможности проведения терапии НПВП на фоне хронического диффузного заболевания печени также весьма ограничены. Так, при наличии хронического диффузного заболевания печени перед назначением НПВП обязательным является исследование биохимических маркеров синдромов цитолиза гепатоцитов и холестаза: АлАТ, АсАТ, ГГТП, билирубина, ЩФ. Превышение данных показателей в 2 и более раза относительно верхней границы нормы указывает на невозможность проведение терапии НПВП. В случае наличия хронического диффузного заболевания печени, но незначительного отклонения (не превышающего норму более чем в 2 раза) вышеуказанных биохимических показателей терапия НПВП возможна, но при этом необходимо использовать препараты с минимальным гепатотоксическим потенциалом (напроксен, целекоксиб). При отсутствии у пациента факторов риска гепатоксичности теоретически возможно применение любого официально зарегистрированного НПВП. Однако на практике следует все же воздержаться от использования НПВП с доказанной гепатоксичностью – сулиндака, ибупрофена и нимесулида. Кроме того, вне зависимости от гепатотоксического потенциала применяемого в каждом конкретном случае НПВП, необходим динамический контроль биохимических маркеров печеночного цитолиза и холестаза, поскольку возникновение лекарственного повреждения печени – весьма труднопрогнозируемая ситуация. При длительной терапии НПВП периодичность такого контроля должна быть не меньше 1 раза в месяц.
Следует подчеркнуть, что в настоящее время, при практически сходной эффективности большинства современных НПВП, на первый план при выборе конкретного варианта терапии должен выходить все-таки критерий ее безопасности. Приоритет именно данного критерия, положенного в основу представленного алгоритма, направленного на предупреждение или минимизацию побочных эффектов НПВП со стороны печени, позволит избежать неуверенного балансирования на виртуальной грани эффективности и безопасности и проводить лечение в условиях максимального комфорта и для пациента, и для врача.
13 апреля 2016 г.
Ещё больше полезной информации на нашем Телеграм-канале