Цереброваскулярные заболевания относятся к одной из самых распространенных болезней человека. Данная проблема актуальна не только для пожилых людей, но и для лиц молодого возраста: по данным профилактических осмотров населения, они выявляются в 20–30% случаев даже у лиц трудоспособного возраста.
Ишемический инсульт – одна из ведущих причин заболеваемости, летальности и инвалидизации в России и в мире. В России данная проблема особенно актуальна в связи с тем, что смертность от инсульта является самой высокой в мире [20]. Не менее трети инсультов приводят к летальному исходу в остром периоде. В течение последующего года летальность увеличивается еще на 10-15%.
Цереброваскулярные заболевания разделяются на острые (инсульты и преходящие нарушения мозгового кровообращения – транзиторные ишемические атаки), а также хронические формы нарушения мозгового кровообращения (дисциркуляторная энцефалопатия). Это наиболее часто встречающаяся цереброваскулярная патология, приводящая к инвалидизации с нарастанием когнитивных нарушений вплоть до деменции.
Одной из главных причин возникновения ишемических нарушений мозгового кровообращения являются стенозы брахиоцефальных артерий. Атеросклероз является причиной 2/3 поражений брахиоцефальных артерий, причем у мужчин данная патология встречается до 4 раз чаще, чем у женщин, наибольшая частота атеросклеротического поражения приходится на возрастной промежуток от 50 до 60 лет. Атеросклеротическое поражение, как правило, носит сегментарный характер и локализуется наиболее часто в области луковицы (синуса) внутренней сонной артерии [6].
В развитии острых нарушений мозгового кровообращения наряду со степенью сужения просвета сосуда, важное значение имеют структурные особенности бляшки, определяющие степень ее нестабильности. Атеросклеротическая бляшка не является стабильной структурой - под воздействием внешних и внутренних факторов в ней происходит ряд последовательных изменений, вследствие процесса атероматоза, некроза, неоангиогенеза и мелких внутритканевых кровоизлияний, которые впоследствии могут привести к отрыву фрагментов бляшки и стать причиной эмболии.
В настоящее время гемодинамически и патогенетически значимым в отношении развития мозговой сосудистой недостаточности считается стеноз от 70% и более внутренней сонной артерии. При этом могут появляться количественные и качественные изменения кровотока, возникает состояние неустойчивого потока, турбулентное движение крови, уменьшается объемный кровоток по сосуду, что приводит к увеличению риска развития инсульта [19].
Патофизиология развития ишемии головного мозга
Составляя всего 2% веса тела, головной мозг потребляет 15% минутного объема кровотока, при этом потребление мозгом кислорода составляет 3-3,5л на 100 г ткани, что соответствует 20% от всего кислорода, потребляемого организмом.
Общее количество потребляемой головным мозгом человека крови составляет от 600 до 1200 мл/мин. Особенности распределения крови в ткани головного мозга тесно связаны с функциональной активностью и метаболизмом его отделов. Так в кортикальных отделах полушарий головного мозга плотность капилляров в 3 -5 раза выше, чем в белом веществе [13]. Это связано с тем, что на эти отделы головного мозга ложится максимальная физиологическая нагрузка, связанная с более высоким уровнем метаболизма, а соответственно и более интенсивным кровообращением. Согласно современным исследованиям, кровоток в сером веществе головного мозга в номе составляет 50-70 мл/100 г ткани в мин., а в белом веществе 20-25 мл/100 г ткани в мин., поддерживаясь ауторегуляторными механизмами.
Основной механизм повреждения мозговой ткани при инфаркте мозга – это всегда снижение или полное прекращение поступления крови по сосуду, питающему участок вещества мозга, наиболее часто в результате тромбоза или эмболии [1, 2, 4, 5, 12].
Экспериментально установлен [Wade S, 2004, Woodruff M, 2011] алгоритм метаболических реакций ткани мозга на снижение мозгового кровотока (Рис. 1). При снижении уровня кровотока до 70-80% (менее 50-55 мл на 100 г ткани мозга в 1 мин) возникает первая реакция в виде снижения или отключения специфических функций нейрона, вся жизнедеятельность клетки направлена на поддержание собственного гомеостаза, таким образом может формироваться неврологический дефицит [21, 23].
Дальнейшее снижение кровотока до 50% от нормальной величины (до 35 мл/100 г в 1 мин) сопровождается нарушением функции мембраны, резким торможением диффузии, активацией анаэробного гликолиза, увеличением концентрации лактата, развитием лактат-ацидоза [8, 11]. Данный этап повреждения клеток может быть диагностирован с помощью диффузионной МРТ головного мозга.
Нарастающая ишемия (снижение кровотока до 20 мл/100 г в 1 мин) приводит к снижению синтеза аденозинтрифосфата (AТФ), формированию энергетической недостаточности и как следствие - к гидрофильному отеку и некрозу клеток [9]. Признаки отека головного мозга могут быть выявлены с помощью МСКТ головного мозга.
Длительность перечисленных этапов алгоритма реакций ткани мозга на ишемию взаимозависима. Чем длительнее период умеренного снижения мозгового кровотока и сопровождающей его "мягкой" ишемии, тем короче период тяжелой ишемии.
Механизмы компенсации
Компенсация снижения кровотока осуществляется благодаря коллатеральному кровотоку и путем ауторегуляции мозгового кровотока. В норме уровень мозгового кровотока постоянен и не зависит от артериального давления, пока оно находится и в интервале между 60 и 160 мм рт. ст. Способность поддерживать постоянство мозгового кровотока обеспечивается феноменом ауторегуляции [14].
Регуляция мозгового кровотока осуществляется с изменением цереброваскулярной резистивности, которая зависит от диаметра внутримозговых капилляров. При падении перфузионного давления мозговые капилляры расширяются, а при его увеличении сужаются, поддерживая мозговой кровоток на постоянном уровне [3].
Церебральное коллатеральное кровообращение относится к вспомогательной сосудистой сети, которая стабилизирует мозговую гемодинамику в случае нарушения кровообращения в основных артериальных сосудах.
Процесс вовлечения коллатералей зависит от калибра и степени расширения магистральных артерий, которые могут быстро компенсировать уменьшающийся мозговой кровоток и адекватности вторичных путей поступления крови – коллатеральных сосудов. Вначале коллатерали обеспечивают немедленное поступление крови в ишемизированные участки за счет уже существующих анастомозов. Затем вовлекаются такие коллатерали, которые хоть уже анатомически существуют, но требуют времени для раскрытия и увеличения своих возможностей. Скорее всего, открытие коллатералей зависит от гемодинамических, метаболических и нейрорегуляторных факторов [22].
Несмотря на наличие множества специфических патофизиологические факторов, приводящих к развитию коллатералей, уменьшающееся артериальное давление в нижележащих сосудах считается критической переменной [14]. Локальная ишемия мозговой ткани приводит к секреции пептидов, стимулирующих процессы ангиогенеза с возможностью образования коллатералей, хотя эти сосуды скорее служат для выведения продуктов некроза, нежели для поддержания уровня мозгового кровотока. Дальнейшие клинические исследования подчеркивают скорость развития ишемии в качестве показателя, от которого зависит развитие коллатерального кровообращения: чем длительнее время, тем лучше и эффективнее развитие коллатералей [15].
Перфузионная компьютерная томография
Изучение физиологии и метаболических потребностей ткани головного мозга в норме и нормальных показателей мозгового кровотока ведется с середины XX века. Появление компьютерной томографии (КТ) и её развитие во второй половине XX века произвело революцию в диагностике острых нарушений мозгового кровообращения. Теоретическое обоснование возможности проведения и методика перфузионной компьютерной томографии (ПКТ) впервые были описаны в работах L.Axel в 1980 [7]. Однако использование ПКТ в клинической практике стало возможным только в 1990-е годы, и было связано с бурным развитием диагностической техники - появлением мультиспиральных компьютерных томографов с высокой скоростью получения изображения и усовершенствованным программным обеспечением.
Совершенствование технологий сканирования и обработки информации способствовало широкому распространению методики ПКТ - она стала неотьемлемой в неотложной медицинской практике, позволяя визуализировать ядро инсульта и зону окружающей его ишемической "полутени" (англ. penumbra), и оценивать динамику течения ишемического инсульта на фоне лечения.
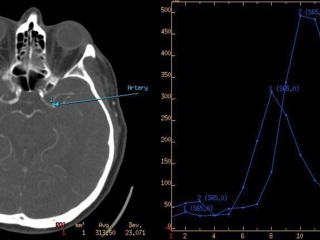
Методы оценки тканевой перфузии головного мозга на основе КТ используют форму и временные характеристики профиля контрастирования в питающих артериях, дренирующих венах и в тканях мозга до, во время и после внутривенного введения болюса контрастного вещества. Для получения подобных временных зависимостей одновременно с введением контрастного препарата проводят серию последовательных КТ-сканирований на заданных уровнях. Существует целый ряд методов анализа временных зависимостей концентрации контрастного вещества для получения количественной оценок тканевой гемодинамики, которые зависят от принятой модели кинетики контрастного вещества.
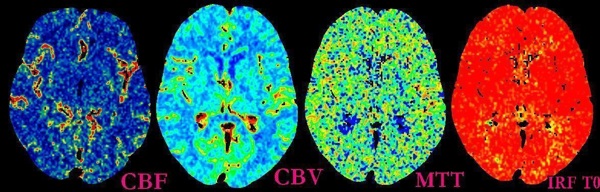
Основными показателями для оценки мозгового кровотока являются:
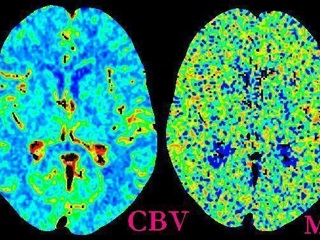
- Сerebral blood volume (CBV, объем мозгового кровотока) – общий объем крови в выбранном участке мозговой ткани. Это понятие включает кровь как в капиллярах, так и в более крупных сосудах – артериях, артериолах, венулах и венах. Данный показатель измеряется в миллилитрах крови на 100 г мозгового вещества (мл/100 г);
- Сerebral blood flow (CBF, объемная скорость кровотока) – скорость прохождения определенного объема крови через заданный объем ткани мозга за единицу времени. CBF измеряется в миллилитрах крови на 100 г мозгового вещества в минуту (мл/100 г x мин.);
- Mean transit time (MTT, среднее время циркуляции) – среднее время, за которое кровь проходит по сосудистому руслу выбранного участка мозговой ткани, измеряется в секундах (с).
- Impulse residual function time (IRF T0) - время поступления контрастного препарата в указанную точку ткани мозга, обозначает начало контрастирования ткани мозга относительно плотности артерии (с.)
Согласно принципу центрального объема, который является общим для всех методов оценки тканевой перфузии, эти параметры связаны соотношением CBV = CBF x MTT.
При проведении ПКТ церебральная перфузия оценивается по картам, построенным для каждого из параметров (Рис. 2), а также по их абсолютным и относительным значениям в соответствующих областях головного мозга. Помимо CBF, CBV, МТТ и IRF T0, может также вычисляться время до достижения максимальной (пиковой) концентрации контрастного вещества (time to peak, TTP). Исследователь может выделить на срезе несколько областей интереса (ROI, region of interest), для которых рассчитываются средние значения показателей церебральной перфузии и строится график «время–плотность».
В настоящее время исследователи по-разному подходят к вопросу выделения областей интереса. Однако, учитывая патогенез острых и хронических нарушений мозгового кровообращения, представляется возможным применять различные методики для решения вопроса об адекватности кровообращения. Так, при ишемических инсультах наибольшее значение имеет оценка кровотока в корковых отделах пораженной области (что может отражать существующую клиническую картину), при развитии хронических нарушений мозгового кровообращения в наибольшей степени поражаются подкорковые структуры.
Таким образом, ПКТ головного мозга должна применяться у пациентов с острыми формами нарушения мозгового кровообращения для ранней диагностики инсульта. Снижение показателей скорости мозгового кровотока у пациентов с односторонним стенозом внутренней сонной артерии должно рассматриваться как дополнительный критерий необходимости хирургического лечения.
Список литературы
- Болезни нервной системы: Руководство для врачей: в 2-х т. – Т.1. Под ред. Яхно Н.Н., Штульмана Д.Р. – 3-е изд., перераб и доп. – М.: Медицина, 2003. – 744 с.
- Верещагин Н.В., Ганнушкина И.В., Суслина З.А, Болдырев А.А., Пирадов М.А., Танащян М.М. с соавт., «Очерки ангионеврологии», М., 2005 г
- Котов C.B., Исакова Е.В., Рябцева A.A. и др. Комплексная терапия хронической ишемии мозга /. Под ред. В.Я. Неретина. - М., 2001. - 532с.
- Скворцова В.И., Крылова В.В. Геморрагический инсульт: практическое руководство.– М. – ГЕОТАР-Медиа, 2005. – 160с.
- Скоромец А.А., Скоромец А.П., Скоромец Т.А. Нервные болезни. М.: Медпресс-информ, 2005. – 544 с.
- Augoustides G.T. John Advances in the Management of Carotid Artery Disease: Focus on Recent Evidence and Guidelines - Journal of Cardiothoracic and Vascular Anesthesia, 2012, Volume 26, Issue 1 , p. 166-171
- Axel L. Cerebral blood flow determination by rapid sequence Computed Tomography: a theoretical analysis. Radiology, 1980, 137, p. 679-686
- Brouns, R & De Deyn, PP. The complexity of neurobiological processes in acute ischemic stroke. Clinical Neurology & Neurosurgery, 2009, 111 (6), p. 483-495
- Colbourne F, Sutherland GR & Auer RN. Electron microscopic evidence against apoptosis as the mechanism of neuronal death in global ishemia - Journal of Neuroscience, 1999, 19(11), p. 4200-4210
- Fisher M, Paganini-Hill A, Martin A, et al. Carotid plaque pathology: thrombosis, ulceration, and stroke pathogenesis. Stroke, 2005; 36, p. 253.
- Forder, JP & Tymianski, M. Postsynaptic mechanisms of excitotoxicity: involvement of postsynaptic density proteins, radicals, and oxidant molecules. Neuroscience, 2009, 158 (1), p. 293-300
- Hankey J. Your Questions Answered. Churchill livingstone. Elsever limited, 2002
- Heiss W.D. Ischemic penumbra: evidence from functional imaging in man /J Cereb Blood Flow Metab.- 2000.-V.20:-P. 1276-1293
- Hobson W Robert, Mackey C William, Ascher Enrico, Murad M Hassan, Calligaro D Keith, Comerota J Anthony Management of atherosclerotic carotid artery disease: Clinical practice guidelines of the Society for Vascular Surgery – Journal of Vascular Surgery, 2008, 48 (2), p. 480-486.
- Manoonkitiwongsa PS, Jackson-Friedman C, McMillan PJ, Schultz RL, Lyden PD. Angiogenesis after stroke is correlated with increased numbers of macrophages: the clean-up hypothesis. J Cereb Blood Flow Metab 2001;21, p. 1223-1231
- Mayberg M.R., Wilson S.E., Yatsu F. et al. Carotid endarterectomy and prevention of cerebral ischemia in symptomatic carotid stenosis: Veterans Affairs Cooperative Studies Program 309 Trialist group / JAMA, 1991, V.266, P.3289-3294.
- Mathias K. Stent placement in supra-aortic artery disease. In: Stents: State of the Art and Future Developments. Liermann D.D. ed. Morin Heights: Polyscience Publication, Inc., 1995; P.87-92
- Papp Z., Patel M., Ashtari M. et al. Carotid artery stenosis, optimization of CT angiography with a combination of shaded surface display and source images / Am J Neuroradiol.- 1997.- V.18.- P.759 -763
- Takaya N, Yuan C, Chu B, et al. Association between carotid plaque characteristics and subsequent ischemic cerebrovascular events: a prospective assessment with MRI-initial results. Stroke, 2006; 37:818.
- The European Stroke Organization (ESO) Executive Committee and the ESO Writing Committee. Guidelines for Management of Ischaemic Stroke and Transient Ischaemic Attack, 2008
- Wade S. Smith Pathophysiology of Focal Cerebral Ischemia: a Therapeutic Perspective – J Vasc Interv Radiol, 2004, 15; p.3-12
- Wei L, Erinjeri JP, Rovainen CM, Woolsey TA. Collateral growth and angiogenesis around cortical stroke. Stroke. 2001; 32: 2179-2184
- Woodruff M Trent, Thundyl John, Sung-Chun Tang, Sobey G Christopher Pathophysiology, treatment and animal and cellular models of human ischemic stroke – Molecular Neurodegeneration, 2011, 6; 11
Можаровская М.А., Бадюл М.И., Морозов С.П., Крыжановский С.М., Шмырев В.И.
18 апреля 2013 г.
Ещё больше полезной информации на нашем Телеграм-канале