Хирургическое лечение множественных атеросклеротических поражений различных артериальных бассейнов.
С.И. Скрылев, В.Л. Щипакин, А.Ю. Кощеев, Н.А. Назарова
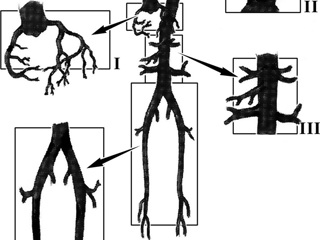
Проблема лечения сочетанного (мультифокального) Окклюзионно-стенотического поражения различных артериальных бассейнов чрезвычайно актуальна. Каждый невролог весьма часто сталкивается с данной категорией больных в своей практике. Современные возможности диагностики сосудистых поражений с использованием таких высокотехнологичных методов исследования, как дуплексное сканирование и компьютерно-томографическая ангиография, позволяют своевременно диагностировать патологический процесс и точно определить локализацию, распространенность и выраженность стенозов. Атеросклероз сосудов одного артериального бассейна является скорее исключением, чем правилом. Поражение артерий двух и более бассейнов расценивается как мультифокальный атеросклероз. Частота сочетанных (мультифокальных) атеросклеротических поражений сосудов различных артериальных бассейнов составляет до 90% [12]. Согласно клинико-функциональной классификации окклюзирующих поражений артериальная система условно разделена на 4 анатомо-функциональных бассейна: коронарный, брахиоцефальный, висцеральный и бассейн артерий нижних конечностей (рис. 1) [6, 7]. Вопрос хирургической тактики, показаний и противопоказаний к хирургическому лечению, видов и очередности выполнения операций у больных с множественными и сочетанными поражениями различных артериальных бассейнов до сих пор дискутируется в мировой литературе [2]. Для реваскуляризации возможны две основные формы вмешательства: эндартерэктомия и шунтирование [6]. Еще в 1923 г. французский хирург-новатор профессор Рене Лериш высказал идею лечения окклюзий брюшной аорты (это поражение с тех пор называют синдромом Лериша) путем иссечения пораженного сегмента и замещения его протезом, тем самым предвосхитив развитие сосудистой хирургии. Только в 1951 г. парижский хирург Удо сообщил о первом случае замещения гомотрансплантатом окклюзированного участка брюшной аорты способом, предложенным Леришем 30 лет назад [2]. История хирургического лечения стенозирующих заболеваний ветвей дуги аорты уходит в 50_е годы ХХ века, когда исследователями были доложены отдельные попытки применения различных хирургических вмешательств, включающих эндартерэктомию и резекцию с венозным протезированием, однако точкой отсчета принято считать 1957 г., когда М.Е. де Бейки с коллегами была выполнена операция у больного с полной окклюзией брахиоцефального ствола с применением шунтирования восходящей аорты с правой общей сонной (ОСА) и подключичной артериями (ПкА) [6, 8, 10, 11]. В том же году у пациента с синдромом позвоночно-подключичного обкрадывания впервые была выполнена эндартерэктомия из левой подключичной и позвоночной артерий (ПА) [6]. Современные взгляды на проблему тактики хирургического лечения мультифокального атеросклероза основаны на представлениях о приоритетности артериальных бассейнов. Традиционно проводится этапное хирургическое лечение [1]. При сочетанном поражении брахиоцефальных артерий, аорты и артерий нижних конечностей в качестве первого этапа принято выполнять реконструкцию ветвей дуги аорты. Показаниями к одномоментным вмешательствам считаются: критический стеноз внутренней сонной артерии (ВСА) или эмболоопасная бляшка ВСА в сочетании с критической ишемией нижних конечностей; критический стеноз ВСА или эмболоопасная бляшка ВСА в сочетании с аневризмой брюшной аорты с признаками расслоения или разрыва [2, 5]. Показания к одномоментным и этапным операциям следует индивидуализировать, а объем и характер операций определять с учетом функциональной значимости поражений.
В данной статье рассмотрено лечение сочетанной патологии сосудов брахиоцефального бассейна и бассейна артерий нижних конечностей.
Больной М., 58 лет, поступил в отделение сосудистой и эндоваскулярной хирургии Научного центра неврологии РАМН 5 декабря 2008 г. с жалобами на онемение, боли в нижних конечностях по типу “перемежающейся хромоты”, неустойчивость, пошатывание при ходьбе, боли в левой руке. Из анамнеза известно, что пациент в течение 3 лет страдает “перемежающейся хромотой” с уменьшением дистанции безболевой ходьбы через 30–50 м, консервативная терапия дает временный непродолжительный эффект. С юности периодически повышалось АД, максимально до 160/100 мм рт. ст. при “рабочем” давлении 120/80 мм рт. ст.; принимал энап с хорошим эффектом. Последние несколько лет гипотензивную терапию не принимает. Периодически на фоне нагрузок отмечал сжимающие боли за грудиной. В 1983 г. перенес аппендэктомию, ушивание прободной язвы желудка с селективной проксимальной ваготомией. Около 3 лет отмечает боли в левой руке. В течение последнего года периодически беспокоят неустойчивость, пошатывание при ходьбе. С 18 ноября по 2 декабря 2008 г. находился на лечении в районной клинической больнице г. Махачкалы, при обследовании выявлены стеноз левой
подключичной артерии более 90%, окклюзия брюшной аорты. Для дообследования и решения вопроса о хирургическом лечении госпитализирован в НЦН РАМН. При поступлении: общее состояние удовлетворительное. Кожные покровы чистые, видимые слизистые обычной окраски. Отеков нет. Тоны сердца ясные, ритмичные, частота сердечных сокращений и пульс 64 в минуту. АД 160/80 мм рт. ст. на правой руке и 110/80 мм рт. ст. на левой руке. Ослаблена пульсация на левой лучевой артерии, на бедренных, подколенных, тыльных артериях стоп с двух сторон пульсация отсутствует. Живот при пальпации мягкий, безболезненный во всех отделах, печень у края реберной дуги. Неврологический статус. В месте, времени, собственной личности ориентирован правильно, менингеальных симптомов нет. Глазные щели, зрачки симметричны, фотореакции живые; снижена конвергенция. Снижение поверхностной чувствительности на лице справа. Сглажена правая носогубная складка. Субъективно снижения слуха нет. Язык при выведении из полости рта расположен по средней линии. Глоточный рефлекс живой, глотание, фонация не изменены. Объем и сила в конечностях полные, мышечный тонус не изменен. Сухожильные и периостальные рефлексы на руках, коленный рефлекс снижены, ахилловы – живые, симметричные; патологических стопных и кистевых знаков нет. Рефлекс Маринеску–Радовича с двух сторон. Правосторонняя гемигипестезия. Координаторные пробы выполняет удовлетворительно. Неустойчив в пробе Ромберга, походка атактическая (по мозжечковому типу). Тазовых расстройств нет.
Результаты проведенного обследования:
• клинико_биохимические показатели в пределах нормы;
• ЭКГ: ритм синусовый, частота сердечных сокращений – 64 в минуту, нормальное положение электрической оси сердца;
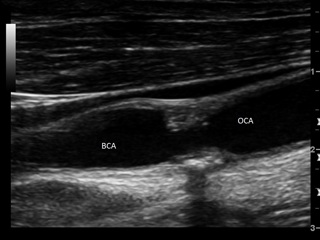
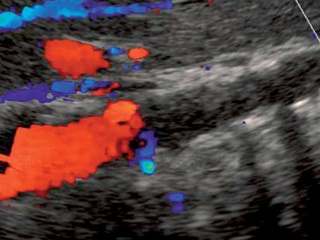
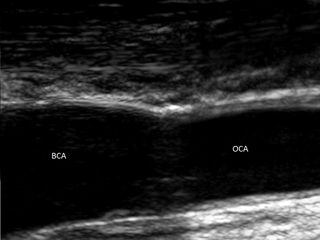
• дуплексное сканирование брахиоцефальных артерий (рис. 2): справа в области бифуркации лоцируется гетерогенная атеросклеротическая бляшка, стенозирующая просвет сосуда на 60%. В устье позвоночной артерии определяется пролонгированная атеросклеротическая бляшка, стенозирующая просвет сосуда до 70%, линейная скорость кровотока в месте стеноза 200 см/с. Слева кровоток по ПА не регистрируется, по подключичной артерии на уровне 1-го сегмента кровоток не регистрируется;
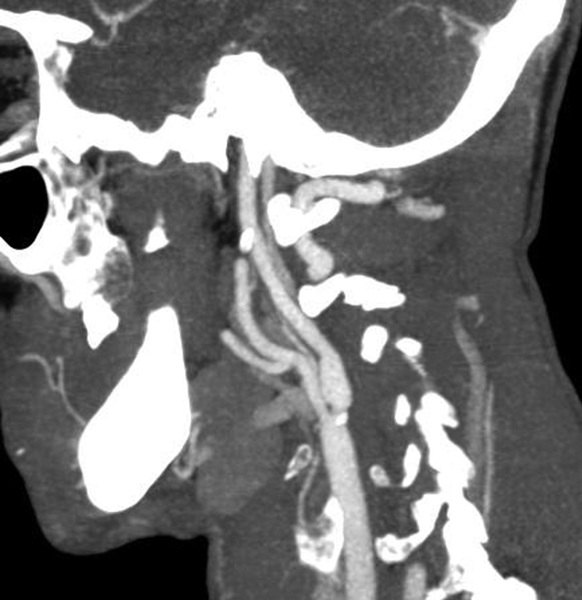
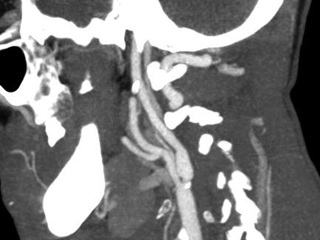
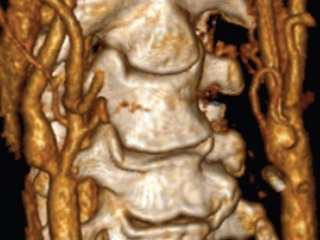
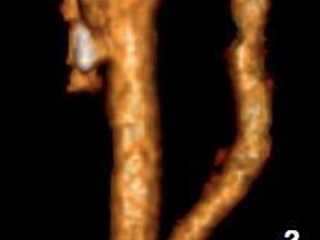
• спиральная КТ-ангиография брахиоцефальных артерий (рис. 3): выраженный стеноз правой внутренней сонной артерии. Кровоток по левой позвоночной артерии не определяется – окклюзия. Окклюзия подключичной артерии в 1-м сегменте. В устье правой позвоночной артерии определяются признаки стеноза;
• КТ головного мозга: очаговой патологии не выявлено. В режиме КТ-перфузии зоны снижения или отсутствия перфузии в головном мозге не определяются;
• стволовые акустические вызванные потенциалы: нарушение внутристволового проведения на медуллопонтинном уровне;
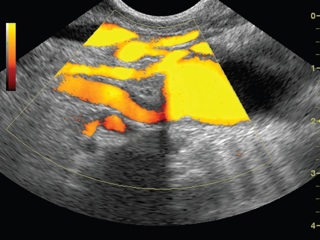
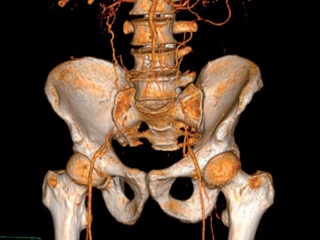
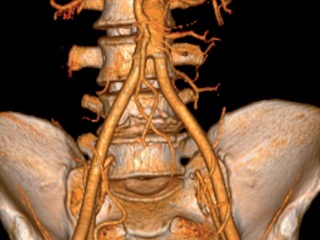
• дуплексное сканирование брюшной аорты и ее ветвей (рис. 4): высокая окклюзия аорты и общих подвздошных артерий с обеих сторон; дистальное сосудистое русло проходимо;
• КТ-ангиография брюшной аорты и сосудов нижних конечностей (рис. 5): определяется высокая окклюзия брюшного отдела аорты;
• терапевт: Артериальная гипертензия II степени. ИБС: стенокардия 2 ФК. Язвенная болезнь двенадцатиперстной кишки, ремиссия. Хроническая обструктивная болезнь легких: хронический бронхит курильщика, ремиссия;
• офтальмолог: Гипертоническая ангиопатия сетчатки. Ангиосклероз;
• ЭхоКГ: зон гипо- и дискинезии не выявлено; фракция выброса 70%;
• УЗИ органов брюшной полости: патологических изменений не отмечено.
На основании проведенного обследования установлен диагноз: Атеросклероз. Стеноз правой внутренней сонной артерии 80%. Стеноз правой позвоночной артерии 70%. Окклюзия левой позвоночной артерии. Окклюзия левой подключичной артерии. Высокая окклюзия брюшного отдела аорты, обеих подвздошных артерий. Вертебрально-базилярная недостаточность. Ишемия нижних конечностей 3 стадии. ИБС: стенокардия 2 ФК. Артериальная гипертензия II степени. Язвенная болезнь двенадцатиперстной кишки, ремиссия. Состояние после аппендэктомии от 1983 г. Состояние после ушивания прободной язвы желудка с селективной проксимальной ваготомией. Хроническая обструктивная болезнь легких: хронический бронхит курильщика, ремиссия.
Таким образом, проведенное обследование позволило определить следующие абсолютные показания к хирургическому лечению:
• стеноз правой внутренней сонной артерии 80%;
• стеноз правой позвоночной артерии 70%;
• высокая окклюзия брюшной аорты, декомпенсированная, толерантная к консервативной терапии ишемия нижних конечностей;
• окклюзия левой подключичной артерии. Ишемия левой руки.
По итогам анализа состояния брахиоцефальных артерий, брюшной аорты, подвздошных артерий и артерий нижних конечностей было запланировано восстановление кровообращения в обоих артериальных бассейнах в три этапа хирургического лечения:
• первый этап – стентирование правой внутренней сонной артерии и правой позвоночной артерии;
• второй этап – аорто-бедренное бифуркационное шунтирование;
• третий этап – реконструкция левой подключичной артерии.
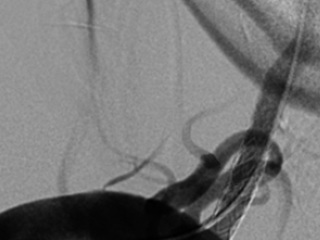
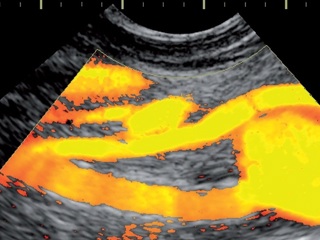
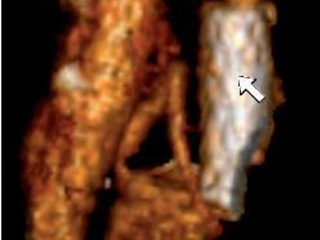
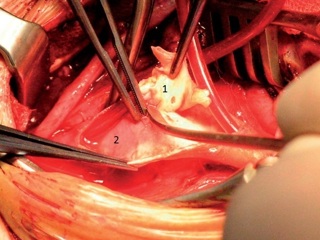
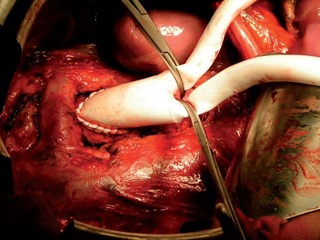
16.12.2008 г. больному было выполнено стентирование (рис. 6). Вмешательство выполнялось из трансаксиллярного доступа, так как у больного имела место высокая окклюзия брюшного отдела аорты и традиционным трансфеморальным доступом выполнить операцию было невозможно. Выполнена рентгеноконтрастная ангиография, при которой подтвержден стеноз правой ПА 75–80%. Установлен стент. Выполнена контрольная ангиография, при которой определяется хорошее восстановление просвета правой ПА. Ввиду использования трансаксиллярного доступа и анатомических особенностей отхождения правой ВСА стентирование этого сосуда оказалось невозможным. При дуплексном сканировании ПА после операции виден стент, установленный в просвете сосуда, который прилежит к стенкам, просвет полностью восстановлен (рис. 7). При КТ_ангиографии также четко визуализируется стент в устье правой ПА (рис. 8). В послеоперационном периоде отмечена положительная динамика при исследовании стволовых акустических вызванных потенциалов в виде уменьшения латентности 1-го пика. При МРТ головного мозга в режиме диффузионновзвешенных изображений в варолиевом мосту левее срединной линии был выявлен небольшой очаг слабо повышенной интенсивности МР-сигнала. Мы расцениваем это как результат артерио-артериальной эмболии из гетерогенной бляшки ВСА. Больной был осмотрен неврологом. Новых жалоб не предъявлял, объективно появления новой или усугубления уже имевшейся неврологической симптоматики не отмечено. В связи с обнаружением “свежего” очага больному была назначена соответствующая консервативная терапия. Так как в ходе первого этапа хирургического лечения стентирования правой ВСА произведено не было, 15.01.2009 г. вторым этапом хирургического лечения выполнена каротидная эндартерэктомия справа с пластикой ВСА синтетической заплатой из политетрафторэтилена (рис. 9). В ходе пробного пережатия сосуда выявлена низкая толерантность к ишемии, поэтому операция проводилась в условиях временного внутреннего шунтирования. Во время операции проводились ультразвуковая эмболодетекция и контроль скорости кровотока по глазничной артерии. При дуплексном сканировании после операции виден восстановленный просвет сосуда (рис. 10). При КТ-ангиографии видно, что стеноз ВСА устранен. Также виден хорошо позиционированный стент ПА (рис. 11). Послеоперационный период протекал без осложнений. Третьим этапом 22.01.2009 г. больному выполнено аорто-бедренное бифуркационное шунтирование (рис. 12). Операция выполняется из трех доступов: лапаротомия + два доступа на бедрах. Сначала выполняется проксимальный анастомоз протеза с аортой, далее бранши бифуркационного протеза проводятся забрюшинно на бедра и пришиваются к общим бедренным артериям. Послеоперационный период протекал без осложнений. Раны зажили первичным натяжением. Швы сняты на 12-е сутки. В послеоперационном периоде болей в ногах в покое нет, восстановилась пульсация на артериях стопы. Увеличилась дистанция безболевой ходьбы. При КТ-ангиографии виден функционирующий протез, кровоток по артериям нижних конечностей полностью восстановлен (рис. 13). После всех оперативных вмешательств пациент получал Фраксипарин в дозировке 0,3 мл 2 раза в сутки начиная с третьего часа после окончания операции в течение 5 сут. Фраксипарин (надропарин кальция) – представитель низкомолекулярных гепаринов, препарат короткоцепочечных мукополисахаридов с молекулярной массой 4000–7000 Да. Эти препараты отличает высокая биодоступность и более длинный (в 2–4 раза) период полувыведения по сравнению с традиционным прямым антикоагулянтом гепарином. Дополнительными преимуществами Фраксипарина являются:
• выраженная активность в отношении подавления Ха_фактора свертывания;
• меньшее связывание с эндотелием сосудов и плазменными белками, что ведет к лучшей усвояемости (до 90%) и быстрой всасываемости препарата из подкожно-жировых депо;
• более длинный период полувыведения (возможны подкожное введение 1–2 раза в сутки и более редкий лабораторный контроль);
• меньшее сродство к фактору Виллебранда, что способствует уменьшению влияния Фраксипарина на тромбоцитарное звено гемостаза и лучшей прогнозируемости антикоагулянтных эффектов даже при использовании высоких доз препарата.
В большом числе рандомизированных исследований у пациентов с цереброваскулярной патологией и различными тактиками консервативного и хирургического лечения было убедительно продемонстрировано, что применение Фраксипарина сопровождается снижением смертности, улучшением функциональных исходов, а также снижением риска инсульта (в том числе повторного) по сравнению с контрольной группой [9, 12]. На сегодняшний день Фраксипарин считается безопасным и наиболее хорошо зарекомендовавшим себя препаратом в ряду низкомолекулярных гепаринов. Его применение в указанной выше дозе широко практикуется нами и большинством сосудистых хирургов в послеоперационном периоде после проведения самых разнообразных реконструктивных и эндоваскулярных вмешательств на сосудах. У рассматриваемого пациента окклюзия левой ПкА сочетается с окклюзией левой ПА и, следовательно, синдрома позвоночно-подключичного обкрадывания нет; имеют место только проявления брахиальной ишемии. Мы считаем, что при стенозах ПкА наиболее оправданным является стентирование, а при окклюзии – реконструктивная операция. Учитывая отсутствие “стил”-синдрома и связанной с ним опасности развития острого нарушения мозгового кровообращения в вертебрально-базилярной системе, реконструкция левой ПкА была запланирована в последнюю очередь.
Таким образом, представленное клиническое наблюдение показывает современные возможности реконструктивной сосудистой хирургии в радикальном патогенетическом лечении множественных атеросклеротических поражений в различных артериальных бассейнах, приводящих к таким серьезным последствиям, как нарушения мозгового кровообращения и критическая ишемия конечностей. Данный случай показателен также в качестве иллюстрации адекватного решения непростой практической задачи выбора и реализации тактики хирургического лечения распространенного атеросклеротического процесса. Успех в работе с данной (и на практике нередкой) категорией больных зависит от своевременного выявления поражений с использованием современных методов диагностики, а также от четкого взаимодействия между врачами-неврологами и ангиохирургами.
Список литературы:
1. Белов Ю.В. Руководство по сосудистой хирургии с атласом хирургической техники. М., 2000.
2. Белов Ю.В. и др. // Ангиология и сосудистая хирургия. 2002. № 1. С. 72.
3. Бурлева Е.П., Фокин А.А. // Ангиология и сосудистая хирургия. 2005. № 3. С. 115.
4. Верещагин Н.В. Патология вертебрально-базилярной системы и нарушения мозгового кровообращения. М., 1980.
5. Гавриленко А.В., Скрылев С.И. // Матер. IV съезда нейрохирургов России. М., 2006. С. 24.
6. Де Бейки М. Особенности окклюзирующих поражений артерий и эффективность их хирургического лечения // История сердечно_сосудистой хирургии / Под ред. Л.А. Бокерия. М., 1997. С. 85–87.
7. Покровский А.В. Заболевания аорты и ее ветвей. М., 1979.
8. Сосудистые заболевания нервной системы / Под ред. Е.В. Шмидта. М., 1975.
9. Фонякин А.В. // Атмосфера. Нервные болезни. 2008. № 3. С. 2.
10. Щипакин В.Л. Реконструктивная хирургия брахиоцефальных артерий у больных с вертебрально-базилярной недостаточностью: Дис. … канд. мед. наук. М., 2005.
11. Bailey C.M.H. et al. // Eur. J. Vasc. Endovasc. Surg. 2003. V. 25. P. 131.
12. Management of peripheral arterial disease (PAD): TransAtlantic Inter_Society Consensus (TASC) // Eur. J. Vasc. Endovasc. Surg. 2000. V. 20. Suppl. A.
Статья опубликована в периодическом издании "Атмосфера. Нервные болезни". М., 2009. №1. с.33-40.
22 апреля 2013 г.
Ещё больше полезной информации на нашем Телеграм-канале