Представлены данные определения субтипа вируса иммунодефицита человека, частоты выявления первичных и вторичных мутаций вируса иммунодефицита человека, выделенных от больных первичной ВИЧ-инфекцией в 2009 и 2011 гг. Всего было изучено 78 образцов. Отмечено сохранение доминирующей роли субтипа А вируса, который был диагностирован в 89,7%. Впервые в СанктПетербурге описана передача первично резистентного штамма ВИЧ от больного, получающего антиретровирусную терапию. Показано, что наиболее частыми мутациями резистентности стали мутации в гене обратной транскриптазы A62V (8 случаев) и в гене протеазы L10I/V/F/R/Y (9 случаев). Проведен анализ выявленных мутаций резистентности и мутаций полиморфизма, определено их значение для назначения оптимальной схемы антиретровирусной терапии.
Внедрение в клиническую практику комбинированной антиретровирусной те- рапии (АРВТ) обеспечило снижение смертности, улучшение качества жизни людей, живущих с вирусом иммунодефицита человека (ЛЖВ), сокращение вероятности пере- дачи вируса иммунодефицита человека (ВИЧ) и уменьшение экономического бреме- ни эпидемии ВИЧ-инфекции [1]. При этом наличие первичной или вторичной рези- стентности вируса к АРВ препаратам резко снижает ее эффективность, что приводит к быстрой селекции высокорезистентных штаммов с последующей передачей их но- вым пациентам. Уровень резистентных штаммов, циркулирующих в популяции ЛЖВ, является серьезным фактором, определяющим выбор противовирусных средств пер- вой линии, и обосновывает различные стратегии подбора эффективных схем АРВТ. В США и странах Западной Европы от 6 до 16% штаммов ВИЧ имеют резистентность, как минимум, к одному классу АРВ препаратов, в том числе 3–5% штаммов резистент- ны более чем к одному классу [2–5]. Таким образом, высокий уровень резистентности к основным АРВ препаратам обуславливает действующие в США клинические реко- мендации по выполнению теста на резистентность каждому вновь выявленному ВИЧ- инфицированному пациенту [6]. До настоящего времени в Российской Федерации со- храняется низкий уровень первичной резистентности ВИЧ. В 2011 г. были опубликова- ны результаты двух исследований по изучению уровня резистентности среди ЛЖВ, не получавших АРВТ. Среди 56 образцов, проанализированных в Московском регионе, был выявлен 1 случай генотипической резистентности — мутация M184V, определя- ющая устойчивость к базовому препарату из группы нуклеозидных ингибиторов обратной транскриптазы (НИОТ) — ламивудину [7]. При изучении 111 образцов от па- циентов Санкт-Петербурга не было выявлено ни одного случая мутации лекарствен- ной устойчивости [8]. Для выработки наиболее оптимальной схемы комбинированной АРВТ необходима актуальная информация об уровне резистентности среди штаммов ВИЧ, циркулирующих в популяции в настоящее время. Эту задачу возможно решить, осуществляя генетический анализ вирусов, выделенных от больных первичной ВИЧ- инфекций, при которой период от момента попадания ВИЧ в организм человека до начала клинических проявлений не превышает нескольких месяцев. При этом в на- стоящее время для оценки уровня резистентности, как правило, используются данные, полученные при анализе материала от пациентов, имеющих различные клинические проявления ВИЧ-инфекции. В этой ситуации не учитывается важнейшая особенность патогенеза ВИЧ-инфекции — длительный скрытый (латентный) период, который про- должается от 1 до 8 лет [1]. В связи с этим информация об уровне резистентности ВИЧ у впервые выявленного пациента, имеющего клиническую симптоматику, отражает ха- рактеристику вируса в момент его проникновения в организм человека, которое про- изошло некоторое время тому назад.
Цель исследования — оценить субтипы и определить генетический полиморфизм генома вирусов иммунодефицита человека, выделенных от больных на стадии первич- ных проявлений в 2009 и в 2011 гг.
Материалы и методы исследования. Исследование выполнено двукратно в 2009 и 2011 гг. в СПБ ГБУЗ «Клиническая инфекционная больница им. С. П. Ботки- на». Проведено изучение образцов сыворотки крови больных с диагностированной острой ВИЧ-инфекцией (2 стадия ВИЧ-инфекции в соответствии с классификацией В. И. Покровского). Диагноз выставлялся комиссионно при наличии клинической кар- тины острого ретровирусного синдрома и результатов лабораторного обследования: двух положительных результатов антиген-антительного ИФА, определение р24 анти- гена ВИЧ в реакции ИФА и неопределенного результата иммунного блота. Всего было обследовано 78 больных, в том числе 49 пациентов в 2009 г. и 29 — в 2011 г. Опреде- ление субтипа ВИЧ выполнено в 2009 г. в 49 случаях, в 2011 г. — в 19 случаях. Анализ генотипической резистентности выполнен у всех 78 больных. Исследование выполне- но совместно с лабораторией молекулярной диагностики ВИЧ ЦНИИ эпидемиологии, консультативно-диагностическим отделением Федерального научно-методического центра по профилактике и борьбе со СПИД (г. Москва) и лабораторией городского центра по профилактике и борьбе со СПИД (Санкт-Петербург). Образцы сыворотки были подвернуты секвенированию с использованием зарегистрированных в Россий- ской Федерации коммерческих наборов ViroSeq HIV-1 Genotype и ViroSeq HIV-1 (Celera Diagnostics), производства компании Abbott. Для генотипирования использовались
7 праймеров для секвенирования всей области гена протеазы ВИЧ (кодоны 1–99) и двух третей гена обратной транскриптазы (кодоны 1–335). Детекция нуклеотидной последовательности осуществлялась на генетическом анализаторе 3100. Определе- ние субтипа ВИЧ-1 проводилось с помощью программы REGA HIV-1 Subtyping tool version 2.0 (http://hivdb.stanford.edu). Программное обеспечение системы генотипиро- вания ViroSeq® HIV-1 использует данные о последовательности, полученные с 7 прай- меров, для каждой пробы и комбинирует информацию в единый проект. Во время сборки последовательностей с праймеров создается консенсус последовательность, которая включает весь ген протеазы и до 335 кодона гена обратной транскриптазы. Это консенсус последовательность сравнивается с референс последовательностью из- вестного штамма (НХВ-2) для идентификации мест вариаций. Пользователь вручную подтверждает или модифицирует вариантные места для гарантии правильных сигна- лов оснований. Затем программное обеспечение генотипирования ViroSeq предлагает пользователю отчет по лекарственной устойчивости к вирусным препаратам, показы- вающий, являются ли обнаруженные мутации генетическим свидетельством устой- чивости вируса. Одновременно с помощью программы Стэнфордского университета осуществлялись интерпретация и клиническое значение выявленных генетических мутаций (http://hivdb.stanford.edu). Хотя при использовании набора ViroSeq произво- дится определение последовательности относительно ограниченного участка генома, использование вышеуказанных программ позволяет определить субтип, получить ин- формацию обо всех выявленных мутациях и получить шкалу устойчивости к АРВ пре- паратам конкретного вируса.
Результаты и обсуждение. В исследуемых группах было показано следующее рас- пределение субтипов ВИЧ-1: в 2009 г. — выявлено 87,7% (43) пациентов, имеющих суб- тип А, 10,2% (5) — субтип В, 2,1% (1) — субтип G; в 2011 г. — 94,7% (18) — субтип А,
5,3% (1) — субтип В. В целом по результатам 2009 и 2011 гг. субтип А ВИЧ доминировал и был выявлен у 89,7% обследованных (61/69). В исследовании выявлен относитель- но высокий уровень образцов ВИЧ, геном региона pol которого оценен как рекомби- нантный. Преобладающим рекомбинантным вариантом ВИЧ был А/АЕ рекомбинант (15/60), вторым вариантом был АЕ/А рекомбинант (6/60). АЕ/АЕ и А/В рекомбинанты выявлены не были.
Полученные данные о преобладании в структуре ВИЧ на территории Санкт- Петербурга субтипа А полностью соответствуют результатам, полученным при ана- лизе ВИЧ от больных, наблюдающихся в Санкт-Петербургском городском центре по профилактике и борьбе со СПИДом. В работе, опубликованной в 2011 г., показано, что доля субтипа А составляет 86,7% среди всех субтипов. При этом авторы отмеча- ют, что половой путь доминирует при передаче не-А субтипов вируса [8]. При анализе механизма передачи среди 513 больных острой ВИЧ-инфекцией, выявленных в Санкт- Петербурге в 2007–2010 гг., отмечено стабильное преобладание полового пути пере- дачи, который установлен более чем у 60% пациентов [9]. Можно считать, что сохране- ние доминирующего субтипа А ВИЧ в Санкт-Петербурге как в период преобладания парентерального пути передачи (1999 — середина 2000-х), так и в период нарастания сексуального пути передачи (середина 2000-х — 2011 г.) свидетельствует о последова- тельном вовлечении в эпидемический процесс потребителей инъекционных наркоти- ков, их половых партнеров, а затем и популяции в целом.
При анализе 78 образцов сывороток методом циклического секвенирования были получены результаты по частоте выявления мутаций в исследуемых образцах. Прове- ден раздельный анализ мутаций устойчивости к АРВ препаратам и мутаций полимор- физма. Данные исследования свидетельствуют, что в 2009 г. мутаций резистентности выявлено не было. В 2011 г. впервые был диагностирован 1 случай выявления первич- ной резистентности — выявление мутации G190S среди штаммов ВИЧ, в настоящее время циркулирующих в Санкт-Петербурге. Высоко резистентный к группе ненукле- озидных ингибиторов обратной транскриптазы (ННИОТ) штамм вируса был выделен от больной с диагностированной острой ВИЧ инфекцией 2В стадии, клиническими проявлениями которой являлись орофарингеальный кандидоз и мононуклеозопо-добный синдром. Заражение произошло половым путем от ВИЧ-инфицированного сексуального партнера, заразившегося из-за употребления инъекционных наркоти- ков. Пациент состоит на диспансерном учете, получает антиретровирусную терапию, включая ненуклеозидный ингибитор обратной транскриптазы. Передача первично резистентного вируса от пациента, находящегося на АРВТ, свидетельствует о ее виру- сологической неэффективности и недостаточной приверженности больного проводи- мому лечению. В данной ситуации назначение больной с резистентным вирусом АРВТ с использованием препаратов первой линии из группы ННИОТ приведет к клиниче- ской и вирусологической неэффективности и формированию мультирезистентных штаммов ВИЧ.
В Российской Федерации широкое применение АРВТ началось в 2005 г. В соот- ветствии с действующими клиническими рекомендациями по АРВТ первая линия сформирована на основе препарата из группы ННИОТ — эфавиренца [10]. Однако в настоящее время наблюдается увеличение доли резистентных штаммов ВИЧ. Вы- зывает серьезную озабоченность крайне высокий уровень резистентности к ННИОТ среди штаммов вирусов, выделенных от ЛЖВ на территории Сибирского федераль- ного округа [11]. При обследовании 179 больных, получающих АРВТ, в 37,4% (67) вы- явлена резистентность к эфавиренцу, в том числе резистентность «высокого» уровня у 55 больных. Вероятно, обследование проводилось среди больных с вирусологической неэффективностью.
Появление в 2011 г. в штамме ВИЧ, выделенном в Санкт-Петербурге от больной острой ВИЧ-инфекцией, мутации первичной резистентности к ННИОТ требует про- ведения ряда мероприятий. К ним относятся усиление комплексной работы с паци- ентами, находящимися на АРВТ, с целью поддержания оптимального уровня привер- женности, проведение дозорных исследований уровня резистентности среди недавно инфицированных ЛЖВ и назначение индивидуализированных схем АРВТ с включе- нием уже в терапию первой линии препаратов с высоким генетическим барьером ре- зистентности.
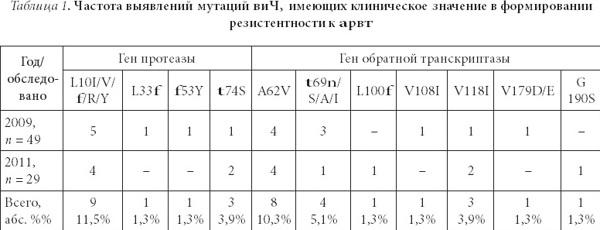
Всего среди 78 образцов ВИЧ, полученных от больных острой ВИЧ-инфекцией в 2009 и 2011 гг., были выявлены 33 значимые мутации резистентности (табл. 1).
Мутации в гене протеазы были представлены только минорными (второстепен- ными) мутациями, которые характеризуются тем, что не затрагивают активный центр фермента и часто обнаруживаются в полиморфных участках не-В субтипа ВИЧ. Наи- более часто выявлялась мутация L10I/V/f/R/Y — 11,5% случаев. Данная мутация встречается у 5–10% ранее нелеченных АРВТ пациентов и вызывает резистентность к препаратам из группы ингибиторов протеазы (ИП) только в присутствии других му- таций резистентности в гене протеазы. В нашем наблюдении мутация носила изолиро- ванный характер, следовательно, штаммы вируса сохраняли свою чувствительность ко всем препаратам из группы ИП. В 5 случаях выявлены иные изолированные минорные мутации в гене протеазы, в том числе в 3 случаях t74S мутация и по 1 случаю мута- ции f53Y и L33f. Эти мутации могут приводить к снижению эффекта двух препаратов из группы ИП — нельфинавира и фосампренавира. При этом, указанные АРВ средства имеют ограниченное применение в клинической практике, а другие ИП, такие как ло- пинавир, атазанавир, дарунавир, эффективны даже при наличии этих изолированных мутаций.
В исследованных образцах было установлено 19 мутаций в гене обратной транс- криптазы. В одном случае была выделена мутация резистентности высокого уровня — G190S. Эта мутация относится к мутациям первичной устойчивости к АРВ препара- там из класса ННИОТ. Эта мутация вызывает устойчивость высокого уровня к эфа- виренцу и невирапину и снижает чувствительность к делавердину. В описываемом случае имеется изолированная мутации G190S, которая может быть преодолена при использовании нового препарата из группы ННИОТ — этравирина. Однако сочетание указанной мутации с иными мутациями резистентности группы ННИОТ (например, Y181) приводит к высокой устойчивости и к этому лекарственному средству, обеспе- чивая таким образом кросс-резистентность ко всему классу ННИОТ.
Среди мутаций в гене обратной транскриптазы наиболее часто выявлялась мута- ция A62V (8 случаев). Клиническое значение этой мутации состоит в увеличении рези- стентности вируса к препаратам группы нуклеозидных ингибиторов обратной транс- криптазы (НИОТ) при условии ее сочетания с мутацией Q151M. В изучаемых образ- цах мутация A62V носила изолированный характер и не обеспечивала формирования фармакологической резистентности ВИЧ. Мутация t69n/S/A/I отмечена в 4 образцах. Является мутацией резистентности к НИОТ, однако ее эффект в клинической прак- тике в настоящее время определен недостаточно. В 3-х случаях установлена мутация V118I, которая выявляется у 2% нелеченных ЛЖВ, ее частота повышается среди попу- ляции больных, находящихся на АРВТ. Клинический эффект ее проявляется в синер- гетическом действии с тимидин-ассоциированными мутациями в виде снижения чув- ствительности вируса к препаратам из группы НИОТ. Важное клиническое значение имеет выявление мутаций резистентности V179D/E и V108I, которые потенциально могут снижать чувствительность ВИЧ к невирапину и эфавиренцу в 2 раза. Мутация V179D в сочетании с мутацией K103n снижает чувствительность к невирапину и эфа- виренцу в 10 раз, таким образом обеспечивая полное сохранение репликативной ак- тивности ВИЧ в присутствии АРВТ. Однократно была детектирована мутация L100f. При этом наиболее частым вариантом изменений в кодоне 100 вируса является L100I мутация, которая в комбинации с мутацией K103n обеспечивает резистентность вы- сокого уровня к препаратам «первой линии» из группы ННИОТ — невирапину и эфа- виренцу — и резистентность среднего уровня (снижение чувствительности вируса бо- лее чем в 5 раз) к новым ННИОТ — этравирину и рилпивирину. Выявленная мутация L100f является редким вариантом мутаций с сохранением чувствительности к АРЕ препаратам.
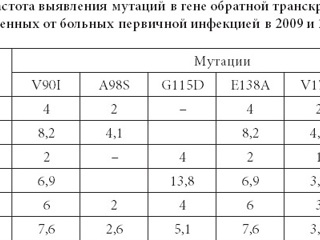
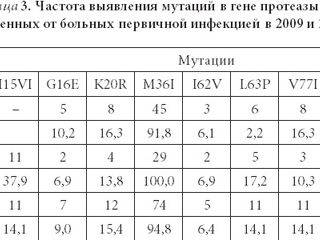
Наряду с первичными мутациями у больных острой ВИЧ-инфекцией выявлены
вторичные мутации (табл. 2, 3).
Данные мутации, также обозначаемые как мутации полиморфизма, появляются в геноме ВИЧ спонтанно, более того, у части генетических вариантов ВИЧ они реги- стрируются постоянно и отражают генетическое разнообразие популяции вируса. Эти мутации не оказывают выраженного действия на устойчивость ВИЧ к АРВ препара- там, однако возможно, что наличие мутаций полиморфизма может оказывать потен- циальное действие по снижению эффективности АРВТ. Клиническая необходимость осуществления мониторинга мутаций полиморфизма ВИЧ определяется следующим положением. Несмотря на то, что каждая из мутаций полиморфизма не оказывает пря- мого влияния на формирование резистентности, может происходить синергетическое усиление действия двух и более мутаций. Соответственно, наличие изолированной мутации резистентности может не приводить к вирусологической неэффективности, а наличие той же мутации в сочетании с мутациями полиморфизма может формиро- вать резистентность вируса к АРВТ.
Среди обследованных образцов выявлено 6 мутаций, отнесенных к мутайиям лиморфизма в гене ОТ. Частота их выявлена была относительно невысокой и состав- ляла от 2,6 до 11,5%. Наиболее часто были диагностированы мутации G333D/E, E138A и V90I. Мутация E138A, являясь мутацией полиморфизма, может оказывать влияние на увеличение резистентности к препаратам из группы ННИОТ второго ряда (этра- вирин и рилпивирин) при ее сочетании с иными мутациями резистентности к группе ННИОТ.
Мутации полиморфизма в гене протезы отмечались более часто. Всего было выяв- лено 11 различных мутаций, встречаемых с различной частотой. Мутации L89M, I93L, M36I, отражая генетическое разнообразие вируса, наблюдались практически во всех образцах (91,0–94,8%). При этом мутация M36I может иметь слабое влияние на рези- стентность к ИП среди субтипа В ВИЧ. Мутации L63P, V77I, V82I, встречаемые с часто- той от 1,3 до 14,0%, являются типичными мутациями полиморфизма, при этом счита- ется, что их селекция может обуславливаться воздействием препаратов из группы ИП. В 15,4% случаев была выявлена мутация K20R, которая, являясь мутацией полимор- физма, тем не менее может оказывать незначительно влияние на снижение чувстви- тельности вируса к препаратам из группы ИП. В случаях выявления иного варианта этой мутации — K20I/M/t/V, может происходить потенциальное снижение чувстви- тельности к нельфинавиру, при селективном давлении которого, возможно, и форми- руется указанная мутация. Клиническое значение мутаций I13V, I15IV, G16E, I62V, вы- явленных у пациентов первичной ВИЧ-инфекцией, в настоящее время не установлено.
Таким образом, впервые в Санкт-Петербурге документирована передача первично резистентного штамма ВИЧ от пациента, находящегося на неэффективной антиретро- вирусной терапии. Уровень резистентных штаммов, выделенных от больных первич- ной ВИЧ-инфекцией, является низким (0/49 в 2009 г. и 1/29 в 2011 г.).
Антиретровирусная терапия на основе препаратов из группы нуклеозидных и не- нуклеозидных ингибиторов обратной транскриптазы сохраняет свое значение в каче- стве эффективной схемы первой линии для ранее нелеченных пациентов. Наиболее часто выявлялись мутации в гене обратной транскриптазы A62V (10,3%) и в гене про- теазы L10I/V/f/R/Y (11,5%). Отмечается тенденция к нарастанию числа мутаций в гене обратной транскриптазы. Несмотря на преобладание в Санкт-Петербурге с середины
2000-х гг. полового пути передачи ВИЧ-инфекции отмечается сохранение доминирую- щего значения субтипа А вируса иммунодефицита человека.
Литература
1. Вирус иммунодефицита человека — медицина: руководство для врачей / под ред. Н. А. Белякова и А. Г. Рахмановой. СПб., 2011. 656 с.
2. Little S. J., Holte S., Routy J. P. et al. Antiretroviral-drug resistance among patients recently infected with HIV
// n. Engl. J. Med. 2002. Vol. 347(6). P. 385–394.
3. Weinstock H. S., Zaidi I., Heneine W. et al. The epidemiology of antiretroviral drug resistance among drug-
naive HIV-1-infected persons in 10 US cities // J. Infect. Dis. 2004. Vol. 189(12). P. 2174–2180.
4. Wensing A. M., van de Vijver D. A., Angarano G. et al. Prevalence of drug-resistant HIV-1 variants in un-
treated individuals in Europe: implications for clinical management // J. Infect. Dis. 2005. Vol. 192(6). P. 958–966.
5. Cane P., Chrystie I., Dunn D. et al. time trends in primary resistance to HIV drugs in the United Kingdom:
multicentre observational study // BMJ. 2005. Vol. 331(7529). P. 1368.
6. Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents Downloaded
from http://aidsinfo.nih.gov/guidelines on 8/6/2012.
7. Nosik M., Ryzhov R., Kravtchenko A. et al. Genotypic analyses of HIV in antiretroviral-naïve patients from Moscow and Moscow region, Russia // 6th IAS Conference on HIV Pathogenesis, treatment and prevention — Rome, 2011, abstract CDA002.
8. Дементьева Н. Е., Сизова Н. В., Лисицина З. Н. и др. Анализ субтипов и фармрезистентность вари- антов ВИЧ, циркулирующих среди ВИЧ-инфицированных пациентов Санкт-Петербурга // ВИЧ-инфекция и иммуносупрессии. 2011. Т. 3. С. 34–42.
9. Мусатов В. Б., Семенова М. Е., Карнаухов Е. В. Эпидемиологическая и демографическая характери- стика взрослых больных с острой ВИЧ-инфекцией // Альманах «Инфекционные болезни — 2012» Под об- щей редакцией А. В. Королева, В. Е. Жолобова и др. СПб.: Изд-во ФХ СПбГУ, 2012. С. 189–191.
10. Покровский В. В., Юрин О. Г., Кравченко А. В. и др. Протоколы лечения больных ВИЧ-инфекцией// Эпидемиология и инфекционные болезни. Актуальные вопросы. 2011. Приложение № 3. 24 с.
11. Коломеец А. Н., Сергеева И. В. Анализ распространенности лекарственной устойчивости ВИЧ-1 в регионах Сибирского федерального округа // Здоровье населения и среда обитания. 2012. № 1 (226).С. 22–24.
Статья поступила в редакцию 5 декабря 2012 г.
ЖУРНАЛ: ВЕСТНИК САНКТ-ПЕТЕРБУРГСКОГО УНИВЕРСИТЕТА. СЕРИЯ 11: МЕДИЦИНА Издательство: Санкт-Петербургский государственный университет (Санкт-Петербург) ISSN: 1818-2909 Номер: 1 Год: 2013 Страницы: 171-178
В. Б. Мусатов, А. А. Яковлев, Т. В. Тыргина, Н. Н. Ладная
Мусатов Владимир Борисович — канд. мед. наук, доцент, Санкт-Петербургский государственный университет; e-mail doctormusatov@gmail.com
Яковлев Алексей Авенирович — д-р мед. наук, профессор, Санкт-Петербургский государственный университет; e-mail iakovlevhome1956@yahoo.com
Тыргина Татьяна Вячеславовна — канд. мед. наук, ФГБУ «Клиническая больница № 1» Управле- ния делами Президента Российской Федерации; e-mail: tatyana.tyrgina@gmail.com
Ладная Наталья Николаевна — канд. мед. наук, Федеральный научно-методический центр по профилактике и борьбе со СПИДом; e-mail: nladnaia@hotmail.com
© В. Б. Мусатов, А. А. Яковлев, Т. В. Тыргина, Н. Н. Ладная, 2013
29 мая 2013 г.
Ещё больше полезной информации на нашем Телеграм-канале