В последние годы в периодической печати все чаще появляются сообщения об осложнениях терапии нестероидными противовоспалительными препаратами (НПВП), прежде всего – о токсическом действии данных лекарственных средств на желудочно-кишечный тракт. Учитывая крайнюю востребованность нестероидных препаратов в современной амбулаторной и госпитальной практике и колоссальный объем их рецептурного и безрецептурного отпуска, проблема осложнений терапии НПВП для популяции в целом становится весьма острой.
Проблема нестероидной гастропатии традиционно находится на стыке нескольких врачебных специальностей: с одной стороны – неврологи, ревматологи и терапевты, наиболее часто назначающие НПВП, с другой стороны – гастроэнтерологи, которые по определению, должны выявлять и лечить пациентов с нестероидной гастропатией. Но, к сожалению, наиболее часто с НПВП-индуцированным повреждением пищеварительного тракта приходиться сталкиваться хирургам. Это происходит из-за характерных особенностей клинического течения НПВП-индуцированной гастропатии, прежде всего – скудности или отсутствия симптоматики, приводящих пациентов уже не на амбулаторный прием к гастроэнтерологу, а в отделения неотложной хирургии. При этом хирургам приходится заниматься лечением не пациентов с «абстрактной журнальной» гастро- и энтеропатией, а пациентов с желудочно-кишечными кровотечениями и перфорациями, являющимися жизнеугрожающими осложнениями НПВП-индуцированных язв. Результаты этого лечения остаются весьма неутешительными: общая летальность при возникновении кровотечения или перфорации НПВП-индуцированных язв как в гастродуоденальной зоне, так и в тонкой кишке, достигает 27 – 30%.
Очевидно, что широкий спектр побочных эффектов традиционных НПВП со стороны органов пищеварения не ограничен лишь их гастротоксичностью. Не менее значимой проблемой, связанной с широким применением НПВП, является гепатотоксический потенциал данной группы лекарственных средств. На первый взгляд мишени токсического воздействия НПВП различны – слизистая оболочка пищеварительной трубки и печеночная паренхима. Однако говорить о разнонаправленном побочном действии данной группы препаратов было бы слишком упрощенно. Представляется, что гастро- и гепатотоксичность НПВП могут являться звеньями одной патогенетической цепи, одним из конечных следствий которой может быть возникновение массивной геморрагии из верхнего отдела пищеварительного тракта, что опять-таки находится в компетенции хирургов.
К сожалению, проблема токсического воздействия НПВП на пищеварительный тракт не сводится к описанию только отдельных клинических случаев. По данным наших американских коллег вероятность летального исхода от осложнений терапии нестероидными препаратами сопоставима с таковой от злокачественных новообразований и табакокурения и во много раз превышает вероятность смерти от дорожно-транспортных происшествий или бытовых несчастных случаев. Принимая во внимание высокую частоту токсического воздействия препаратов на пищеварительный тракт, а также трудности диагностики и лечения пациентов с данной патологией, большинство современных исследователей в своих работах подчеркивает, что только целенаправленная патогенетически обоснованная профилактика может явиться тем единственным средством, которое способно предотвратить зачастую фатальные осложнения терапии НПВП, и тем самым сохранить жизнь больному.
Выбор в каждом конкретном случае того или иного НПВП очевидно определяется балансом его эффективности и безопасности. Анализ отечественных и зарубежных исследований по терапии НПВП дает возможность заключить, что современные нестероидные препараты (диклофенак, напроксен, ибупрофен, кетопрофен, нимесулид, мелоксикам, целекоксиб) по своей эффективности в плане воздействия на локальную или системную воспалительную реакцию, ноцицептивную боль и гипертермию являются вполне сопоставимыми друг с другом. В качестве примера можно привести отчет R. Deyo et al. (2008), основанный на данных Cochrane Database of Systemic Reviews, о проведенном мета-анализе 65 многоцентровых исследований (11237 пациентов), посвященных оценке эффективности НПВП при дорсалгиях. На основании проведенного исследования авторы заключили, что на сегодняшний день получены четкие доказательства того, что современные НПВП, включая ингибиторы ЦОГ-2 (коксибы) обладают сходной противовоспалительной и анальгетической активностью и сопоставимой клинической эффективностью. Тем не менее, как показывает практика, предпочтение того или иного препарата по критерию его эффективности, как правило, определяется сугубо субъективным фактором, а именно - личным опытом врача. С другой стороны выбор НПВП по критерию его безопасности в отношении пищеварительного тракта должен быть основан только на объективном факторе токсического потенциала данного препарата на слизистую пищеварительной трубки и на печеночную паренхиму.
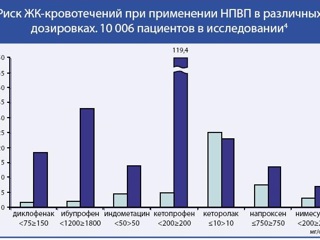
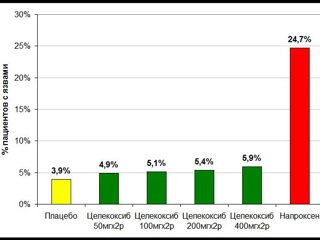
Токсический потенциал каждого конкретного НПВП в отношении слизистой пищеварительной трубки следует рассматривать, используя только альтернативную оценку: безопасен данный препарат или нет. Учитывая, что с увеличением дозы почти всех НПВП увеличивается их повреждающее действие на слизистую пищеварительной трубки, критерием безопасности нестероидного препарата является отсутствие у него дозозависимой гастротоксичности (диагр. 1, 2, 3). В свою очередь сама дозозависимая гастротоксичность определяется неселективным ингибированием традиционными НПВП обоих изоферментов циклооксигеназы 1 и 2 типа (ЦОГ-1 и ЦОГ-2). Именно по этой причине в классификациях американской Food and Drug Administration (FDA) и европейской European Medicines Agency (EMEA) все НПВП подразделяются на селективные ингибиторы ЦОГ-2 (коксибы), не обладающие дозозависимой гастротоксичностью и потому безопасные в отношении слизистой пищеварительной трубки, и на неселективные ингибиторы ЦОГ-2 (все остальные НПВП), обладающие дозозависимой гастротоксичностью и потому повреждающие слизистую пищеварительной трубки. Используемые некоторыми отечественными авторами градации НПВП на «селективные и высокоселективные ингибиторы ЦОГ-2», или на «неселективные, селективные и высокоспецифичные ингибиторы ЦОГ-2», подразумевающие наличие количественного различия в селективности, вносят в работу практического врача много путаницы и, очевидно, не должны применяться. В настоящее время имеется только один класс нестероидных препаратов, не обладающих дозозависимой гастротоксичностью и поэтому безопасных в отношении слизистой пищеварительной трубки, а именно – коксибы, единственным представителями которых, зарегистрированными в России, являются целекоксиб и эторикоксиб.
Токсическое воздействие НПВП на печеночную паренхиму является еще одним фактором, определяющим необходимость дифференцированного подхода при назначении каждому конкретному больному того или иного нестероидного средства. Большинство исследователей подчеркивает, что риск лекарственного поражения печени возрастает при наличии хронического диффузного заболевания печени любой этиологии. При этом нарушение метаболизма лекарств прямо пропорционально признакам хронической печеночноклеточной недостаточности, наиболее выраженной при циррозе печени. Как указывают H. Tan et al. (2007), клинико-морфологические формы токсического воздействия НПВП на печень могут быть весьма вариабельными: острый гепатит, холестаз, холестатический гепатит, имеющий тенденцию к хронизации гранулематозный гепатит, хронический холестаз с дуктопенией, желтая атрофия печени, проявляющаяся фульминантной печеночной недостаточностью. N. O’Connor et al. (2003) приводит два наиболее часто упоминающихся в литературе механизма повреждения печеночной паренхимы НПВП: 1) реакции гиперчувствительности, 2) метаболическое повреждение (аберрация). R. Bort et al. (1999) на основании обобщения экспериментальных данных представили последовательность событий при повреждении гепатоцита НПВП следующим образом. Основной мишенью НПВП на субклеточном уровне являются митохондрии. В процессе метаболизма НПВП цитохромом Р450 образуются производные НПВП, которые способны влиять на процессы переноса электронов в дыхательной цепи на кристах митохондрий, приводя к нарушению окислительного фосфорилирования, синтеза АТФ и энергетическому дефициту в клетке. Не исключено, что токсическим влиянием на митохондрии обладают и нативные НПВП. Нарушение процессов окислительного фосфорилирования в митохондриях и микросомальное окисление некоторых НПВП (например, напроксена) приводят к активации свободно-радикального окисления, результатом чего в конечном счете является дезорганизация мембран, гибель гепатоцита и синтопичных клеточных структур (клетки желчных протоков). Возможно, что в процессе дезорганизации цитолемма приобретает антигенные свойства, что приводит к индукции аутоиммунного ответа и морфологически проявляется как перипортальный отек и момонуклеарная инфильтрация.
По данным L. Garcia-Rodriguez et al. (1994), C. Sgro et al. (2002), I. Lacroix et al. (2004) к факторам риска развития НПВП-индуцированного повреждения печени следует относить: женский пол пациента, возраст старше 56 лет, наличие хронического аутоиммунного заболевания, наличие хронического диффузного заболевания печени, снижение функции почек, гипоальбуминемия, терапия высокими дозами НПВП наличие хронического заболевания, требующего приема НПВП, полипрагмазия.
При назначении НПВП длительным курсом или при лечении пациентов с проявлениями «идиопатической» печеночной недостаточности следует помнить о возможности трансформации гепатоксического потенциала НПВП в реальное повреждение печени с трудноконтролируемыми последствиями в виде фульминантной печеночной недостаточности и гепаторенального синдрома. Учитывая крайне ограниченную в России возможность трансплантации печени, для большинства пациентов подобные осложнения терапии НПВП становятся фатальными. Очевидно, что с клинической, да и с экономической точки зрения целесообразнее не пассивно контролировать возможные проявления гепатотоксичности (которая очень быстро сама по себе способна стать неконтролируемым процессом), а исключить саму причину гепатотоксичности. Тем боле, что для современной клинической практики доступен целый ряд НПВП, чья гепатотоксичность выражена в минимальной степени. почках м анная ситуация приводя длительного и неселективными НПВП приводят к дисбалансу в системе эндотелины (вазоконстрикция)
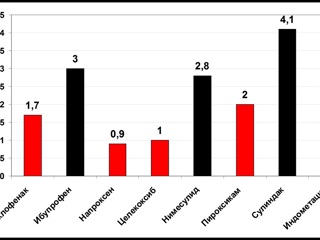
В обширном аналитическом отчете J. Rubenstein et al. (2004), являющимся результатом мета-анализа 8 клинических исследований гепатотоксичности НПВП, помимо установленного общего риска клинически значимого НПВП-индуцированного повреждения печени в популяции (4,8 – 8,6 / 100000 пациентов в год), приводятся данные об индивидуальных различиях гепатотоксического потенциала современных НПВП. Наибольшим потенциалом в плане НПВП-индуцированной гепатотоксичности обладают сулиндак и индометацин. Наименьшей гепатотоксичностью, исходя из результатов проведенных исследований, обладают селективный ингибитор ЦОГ-2 целекоксиб и традиционный НПВП напроксен.
Таким образом, выбор безопасного в отношении пищеварительного тракта НПВП представляет собой весьма непростую задачу, требующую оценки целого ряда факторов. Такая оценка может быть представлена в виде пошаговых алгоритмов для выбора наиболее безопасного в отношении слизистой пищеварительной трубки и печеночной паренхимы НПВП.
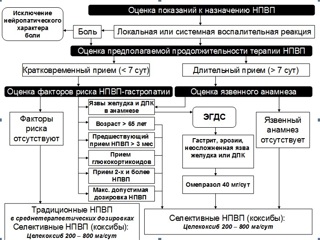
Первым этапом алгоритма выбора безопасного в отношении слизистой пищеварительной трубки НПВП (рис. 1) является тщательная и взвешенная оценка показаний к назначению НПВП. Основным показанием для применения НПВП является локальная или системная воспалительная реакция любой этиологии (инфекционный процесс, травма, аутоиммунные реакции). Хотя наличие болевого синдрома и гипертермии, являющихся проявлением воспаления, служит основанием для назначения НПВП, последние не должны являться препаратами выбора для «чистой» анальгезии или купирования лихорадки. Назначать НПВП при болях следует только при наличии доказанного ноцецептивного компонента, исключив нейропатический характер боли. Напомним, что для купирования нейропатической боли в настоящее время целенаправленно применяется целый ряд препаратов, наиболее эффективным из которых является прегабалин (Лирика®). Дифференцированный подход к анальгезии необходим не только для проведения патогенетической, а значит и эффективной терапии болевого синдрома, но и для предупреждения необоснованного (как правило, длительного и в больших дозах) назначения НПВП. Аналогично, избирательное воздействие на гипертермию при незначительной выраженности воспалительной реакции не должно являться основным поводом к назначению НПВП, в данной ситуации следует предпочесть, например, ацетаминофен.
Следующий этап алгоритма – оценка предполагаемой продолжительности курса терапии НПВП. Известно, что уже через 7 суток от начала лечения нестероидные препараты способны вызвать формирование эрозий и язв на фоне изначально интактной слизистой оболочки желудка и двенадцатиперстной кишки. Поэтому с точки зрения потенциально возможной гастротоксичности терапию НПВП следует разделять на кратковременную (менее 7 суток) и длительную (более 7 суток). Учитывая тот факт, что даже кратковременное назначение НПВП при «компрометированной» слизистой может вызвать ее повреждение, решение о терапии НПВП коротким курсом предполагает обязательное выполнение следующего этапа алгоритма – оценки факторов риска развития НПВП-гастропатии. К ним относятся: применение НПВП в максимально допустимой дозировке, сочетанный прием двух и более НПВП, сочетание НПВП с глюкокортикоидами, предшествующий прием НПВП продолжительностью более 3 месяцев, возраст пациента более 65 лет и, наконец, наличие в анамнезе язвенной болезни, ранее верифицированных острых стресс-язв или НПВП-индуцированных язв. Отсутствие указанных факторов риска возникновения НПВП-гастропатии делает возможным назначение традиционных НПВП в среднетерапевтических дозах с длительностью терапии не более 7 суток. Наличие хотя бы одного или, тем более, нескольких факторов риска развития НПВП-гастропатии определяет невозможность даже краткосрочной терапии традиционными НПВП и, одновременно, необходимость применения безопасных в отношении слизистой пищеварительного тракта селективных ингибиторов ЦОГ-2 – коксибов. Длительная терапия нестероидными препаратами, сама по себе являясь фактором риска развития НПВП-индуцированных эрозий и язв, очевидно, требует назначения коксибов. Следует напомнить, что возможная вариабельность дозировки целекоксиба (от 100 до 800 мг/сут) не влияет на его безопасность в отношении слизистой пищеварительного тракта и делает возможным проведение эффективной терапии данным препаратом при воспалении и болевом синдроме различной выраженности.
Принципиально важным моментом при назначении НПВП является оценка язвенного анамнеза пациента. При наличии субъективных жалоб (характерные боли в эпигастрии, диспепсия) или объективных анамнестических данных, указывающих на возможность или факт существования у больного патологии гастродуоденальной зоны, перед назначением любых НПВП при любой предполагаемой длительности терапии, обязательным является проведение эзофагогастродуоденоскопии (ЭГДС). Наличие гастрита, дуоденита, эрозий и, тем более, язв желудка или двенадцатиперстной кишки полностью исключает возможность применения всех традиционных (неселективных в отношении ЦОГ-2) НПВП и требует проведения специфической терапии, прежде всего – антисекреторными средствами (ингибиторы протонной помпы: омепразол 40 мг/сут). В случае наличия неосложненного эрозивно-язвенного процесса в желудке или ДПК и, одновременно, крайней необходимости в назначении НПВП принципиально возможно одновременное применение целекоксиба и ингибиторов протонной помпы, проводящееся под контролем ЭГДС (еженедельное обследование). Из этого следует, что даже при назначении в качестве НПВП целекоксиба, перед началом терапии не следует пренебрегать клинической (а в случае необходимости – и инструментальной) оценкой состояния слизистой гастродуоденальной зоны, поскольку не диагностированное эрозивно-язвенное поражение делает ошибочным назначение целекоксиба в моноварианте без антисекреторных средств.
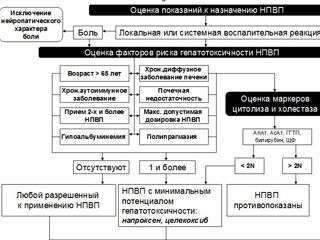
Назначение НПВП с учетом их потенциальной гепатотоксичности также может иметь характер алгоритма (рис. 2), сходного с алгоритмом выбора безопасного в отношении гастродуоденальной слизистой нестероидного средства. На первом этапе, по аналогии с вышеописанным алгоритмом, проводится оценка показаний к назначению НПВП (локальная или системная воспалительная реакция). Затем проводится оценка факторов риска гепатотоксичности НПВП. При этом следует помнить, что гепатотоксическим потенциалом качественно обладают все современные НПВП. С другой стороны, количественный критерий гепатотоксичности позволяет разделить все НПВП на препараты с относительно высоким гепатотоксическим потенциалом (сулиндак, ибупрофен, нимесулид) и препараты с относительно низким гепатотоксическим потенциалом (напроксен, целекоксиб). Кроме того, четкого временного промежутка между началом терапии НПВП и возникновением повреждения печеночной паренхимы до настоящего времени не установлено. Поэтому разделение терапии НПВП на непродолжительную и длительную (по аналогии с гастротоксичностью) с точки зрения реализации их гепатотоксического потенциала является некорректным: развитие цитолитического или холестатического синдрома возможно уже через несколько суток от начала терапии. К факторам риска гепатоксичности НПВП относятся: возраст пациента старше 65 лет, наличие аутоиммунного заболевания, почечной недостаточности, гипоальбуминемия, прием более одного НПВП или прием НПВП в максимальной дозе, одновременное назначение большого числа лекарственных препаратов и, наконец, самое существенное – наличие исходной патологии печени. Следует заметить, что само по себе наличие острой патологии печени с синдромами цитолиза или холестаза, тем более осложненное печеночноклеточной недостаточностью, должно являться противопоказанием к назначению НПВП. Возможности проведения терапии НПВП на фоне хронического диффузного заболевания печени также весьма ограничены. Так, при наличии хронического диффузного заболевания печени перед назначением НПВП обязательным является исследование биохимических маркеров синдромов цитолиза гепатоцитов и холестаза: АлАТ, АсАТ, ГГТП, билирубина, ЩФ. Превышение данных показателей в 2 и более раза относительно верхней границы нормы указывает на невозможность проведение терапии НПВП. В случае наличия хронического диффузного заболевания печени, но незначительного отклонения (не превышающего норму более чем в 2 раза) вышеуказанных биохимических показателей терапия НПВП возможна, но при этом необходимо использовать препараты с минимальным гепатотоксическим потенциалом (напроксен, целекоксиб). При отсутствии у пациента факторов риска гепатоксичности теоретически возможно применение любого официально зарегистрированного НПВП. Однако на практике следует все же воздержаться от использования НПВП с доказанной гепатоксичностью – сулиндака, ибупрофена и нимесулида. Кроме того, вне зависимости от гепатотоксического потенциала применяемого в каждом конкретном случае НПВП, необходим динамический контроль биохимических маркеров печеночного цитолиза и холестаза, поскольку возникновение лекарственного повреждения печени – весьма труднопрогнозируемая ситуация. При длительной терапии НПВП периодичность такого контроля должна быть не меньше 1 раза в месяц.
В заключение считаем необходимым еще раз подчеркнуть, что в настоящее время, при практически сходной эффективности большинства современных НПВП, на первый план при выборе конкретного варианта терапии должен выходить критерий ее безопасности. Приоритет именно данного критерия, положенного в основу представленных алгоритмов, направленных на предупреждение или минимизацию побочных эффектов НПВП со стороны пищеварительного тракта, позволит избежать неуверенного балансирования на виртуальной грани «эффективность vs. безопасность» и проводить лечение в условиях максимального комфорта и для пациента, и для врача.
Список литературы:
- An Evidence-Based Approach to Prescribing Nonsteroidal Antiinflammatory Drugs. Third Canadian Consensus Conference. The Journal of Rheumatology 2006; 33:1.
- Bareille MP, Montastruc JL, Lapeyre-Mestre M. Liver damage and nonsteroidal anti-inflammatory drugs: case non-case study on the French pharmacovigilance database. [in French] Therpaie 2001; 56:51–5.
- Bjorkman D. Nonsteroidal anti-inflammatory drug associated toxicity of the liver, lower gastrointestinal tract and the esophagus. Am J Med 1998; 105:17–21S.
- Bombardier C. An evidence-based evaluation of the gastrointestinal safety of coxibs // Am. J. Med. - 2002. - № 89: (suppl.). - P. 3D-9D. 117
- Cochrane Database of Systemic Reviews, 2008, Issue 1.
- Crofford L. J., Lipsky P. E., Brooks P. et al. Basic biology and clinical application of specific cycloxygenase-2 inhibitors // Arthritis Pheum, 2000. - № 43. - P. 33 157-33 160.
- Deny S., Loke Y. K. Risk of gastrointestinal haemorrage with long term use of aspirin // BMJ. - 2000. - № 321. - P. 1183-1187.
- Fitzgerald G. A., Patrono C. The Coxibs, selective inhibitors of cyclooxygenase-2// New Engl. J. Med. - 2001. - Vol. 345. - P. 433-442.
- Fries J.F. NSAID gastropathy: the second most deadly rheumatic disease? Epidemiology and risk appraisal. J Rheumatol, 2000, 58(Suppl 28), 6-10.
- Garcia-Rodriguez L. A. t al. Risk of hospitalisation for upper gastrointestinal tract bleeding associated with Ketorolac, other NSAIDs, calcium antagonists, and other antihypertensive drugd // Arch. Intern. Med. - 1998. - № 158. - P. 33-39.
- Goldstein J.L., Silverstein F.E., Agrawal N.M. et al. Reduced risk of upper gastrointestinal ulcer complications with celecoxib, a novel COX-2 inhibitor. Am J Gastroenterol, 2000, 95, 1681-1690
- Goldstein J.L., Silverstein F.E., Agrawal N.M. et al. Reduced risk of upper gastrointestinal ulcer complications with celecoxib, a novel COX-2 inhibitor. Am J Gastroenterol, 2000, 95, 1681-1690
- Greaves RR, Agarwal A, Patch D, et al. Inadvertent diclofenac rechallenge from generic and non-generic prescribing, leading to liver transplantation for fulminant liver failure. Eur J Gastroenterol Hepatol 2001; 13:71–3
- http://www.emea.europa.eu/pdfs/human/press/pr/24732305en.
- http://www.fda.gov/cder/drug/infopage/cox2/
- Lanas A. et al. Am J Gastroenterol. 2005;100:1685 – 1693.
- Maddrey WC, Maurath CJ, Verburg KM, et al. The hepatic safety and tolerability of the novel cyclo-oxygenase-2 inhibitor celecoxib. Am J Ther 2000; 7:153–8.
- Merlani G, Fox M, Oehen HP, Cathomas G, Renner EL, Fattinger K, Schneeman M, Kullak-Ublick GA. Fatal hepatotoxicity secondary to nimesulide. Eur J Clin Pharmacol 2001; 57:321–6.
- Pincus T., Swearingen C., Cummins P. at al. Preference for nonsteroidal anti-inflammatory drugs versus acetaminophen and concomitant use of both types of drugs in patients with osteoarthritis. J Rheumatol, 2000, 27, 1020-1027.
- Rabinovitz M, Van Thiel DH. Hepatotoxicity of non-steroidal anti-inflammatory drugs. Am J Gastroenterol 1992; 87: 1696–704.
- Riley TR, Smith JP. Ibuprofen-induced hepatotoxicity in patients with chronic hepatitis C: A case series. Am J Gastroenterol 1998; 93:1563–5.
- Rodriguez-Gonzalez FJ, Montero JL, Puente J, et al. Orthotopic liver transplantation after subacute liver failure induced by therapeutic doses of ibuprofen. Am J Gastroenterol 2002; 97:2476–7.
- Sgro C, Clinard F, Ouazir K, et al. Incidence of drug-induced hepatic injuries: a French population-based study. Hepatology 2002; 36:451–5.
- Silverstein F.E., Faich G., Goldstein J.L. at al. Gastrointestinal Toxicity With Celecoxib vs Nonsteroidal Anti-inflammatory Drugs for Osteoarthritis and Rheumatoid Arthritis.The CLASS Study: A Randomized Controlled Trial JAMA, 2000, 284, 1247-1255.
- Simon L. S., Smolen J. S., Abramson S. B. et al Controversies in COX-2 selective inhibition // J. Rheumatol. - 2002. - № 29. - P. 1501-1510. Silverstein FE, et al. Ann Intern Med. 1998;123:241–249.
- Singh G, Lanes S, Triadafilopoulos G. The American Journale of Medicine, 2004, 100-106.
- Singh G., Fort J., Goldstein J. et al. Celecoxib versus naproxen and diclofenac in osteoarthritis patients: SUCCESS–1 study. Am. J. Med., 2006, 119, 255–266.
- Singh G., Rosen R.D. NSAID-induced gastrointestinal complications: the ARAMIS perspective-1997: Arthritis, Rheumatism, and Aging Medical Information System. J Rheumatol Suppl, 1998, 51, 8-16.
- Wongcharatrawee S, Groszmann RJ: Diagnosing portal hypertension. Baillieres Best Pract Res Clin Gastroenterol 2000 Dec; 14(6): 881-94.
28 апреля 2016 г.
Ещё больше полезной информации на нашем Телеграм-канале