Зубарев А.В., Бояринцев В.В., Фёдорова А.А., Сальникова С.В., Бурделова Н.Н., Емельянова Е.Ю., Павловичев А.А. *Кремлевская медицина клинический вестник №1/2016
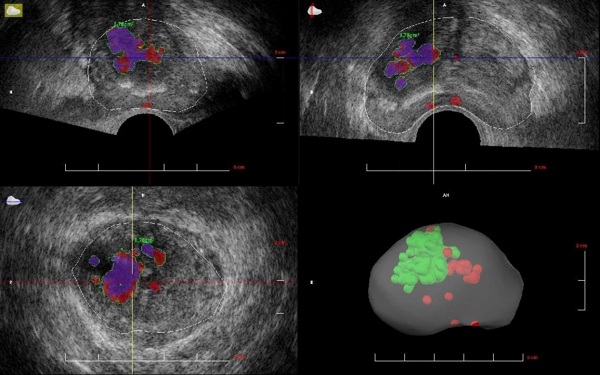
Введение. Рак предстательной железы (РПЖ) выходит на второе место среди причин смерти мужчин [1]. Основными методами диагностики рака предстательной железы на сегодняшний день являются пальцевое ректальное исследование (ПРИ), определение уровня простатспецифического антигена (ПСА) и его модификаций, трансректальное ультразвуковое исследование (ТРУЗИ) с биопсией предстательной железы. Подобный подход к диагностике этого заболевания общепринят как в мировой практике, так и в России. ТРУЗИ получило широкое распространение как наиболее экономичный, простой и в то же время достоверный метод визуализации предстательной железы, обеспечивающий навигацию для биопсии. [11] Тем не менее, большой проблемой при ТРУЗИ остается выявление опухолевых участков, расположенных в центральной и переходной зоне предстательной железы. Важно отметить, что при локализации опухоли в этих зонах простаты, эхо-структура опухолевого участка часто напоминает эхо-структуру аденоматозно измененной ткани. Изучение возможностей ТРУЗИ только в В-режиме при раке простаты показало его низкую специфичность (55-63%) и низкий ОПТ (52-60%). [2]. Применение методик ультразвуковой ангиографии расширяет дифференциально-диагностические возможности ультразвукового метода. Так, чувствительность ТРУЗИ с ангиографией в диагностике РПЖ повышается до 86%, а в режиме ЭК с трехмерной ангиографией – до 90%. [3,4]. Соноэластография (СЭГ) является еще одной современной ультразвуковой методикой, которая уже входит в широкую практику обследования пациентов с различными заболеваниями предстательной железы. Согласно данным литературы, чувствительность СЭГ в диагностике заболеваний предстательной железы составляет от 74 % до 96 % и характеризуется значительной вариабельностью среди различных авторов. [12,6,7]. Применение эхоконтрастирования при заболеваниях предстательной железы следует пока отнести к малоизученным методикам. По данным ряда авторов эхоконтрастная ангиография вносит определенный вклад в повышение информативности метода ТРУЗИ в диагностике РПЖ, позволяя повысить чувствительность с 89 до 94%, специфичность с 86 до 96%, точность с 88 до 95%. [5, 13, 8]. Основным ограничением возможностей ТРУЗИ и его модификаций считается субъективность метода. В связи с этим, перспектива развития метода лежит в объективизации данных ультразвукового исследования. Это может быть достигнуто, например, при выполнении объемного сканирования, с возможностью оценки стандартных срезов в различных плоскостях. Компьютер-ассистированные методики визуализации, основанные на построении трехмерных изображений, и т.н. «фьюжн» технологии, являются наиболее перспективными и предоставляют многообещающие возможности в объективизации ультразвуковых данных при раке простаты [9]. В связи с этим существует необходимость в изучении возможностей инновационных высокоинформативных технологий, таких, например, как ультразвуковое гистосканирование для поиска опухолевых клеток в простате. Гистосканирование предстательной железы это новейшая ультразвуковая технология, которая позволяет выявить наличие рака в предстательной железе с помощью компьютерного анализа отраженных нативных УЗ-сигналов от клеток по всему объему железы [10]. Материалы и методы. Настоящее исследование основано на анализе результатов комплексного обследования 169 пациентов в возрасте от 31 до 98 лет (средний возраст 62,9+10,17 (медиана 64,0) лет). Всем пациентам было проведено клиническое обследование, включающее в себя сбор анамнеза, пальцевое ректальное исследование и определение уровня ПСА. Очаговые изменения при проведении ПРИ были выявлены у 52 пациентов (30,78% от общего количества пациентов). Средний уровень общего ПСА крови пациентов составлял 16,53нг/мл (от 0,62 нг/мл до 350,0 нг/мл). У 26 (15,4%) пациентов уровень общего ПСА составлял менее 4,0 нг/мл, у 85 (50,3%) мужчин уровень ПСА был более 4,0 нг/мл и менее 10 нг/мл, у 58 (34,3%) - более 10 нг/мл. Ультразвуковое исследование проводили в два этапа на ультразвуковом сканере ВК-Medical, Profocus 220 с помощью эндоректального датчика частотой 8-4 Мгц после предварительной подготовки пациента к процедуре ТРУЗИ и при опорожненном мочевом пузыре. На первом этапе производилась оценка структуры ткани простаты и состояние окружающих ее органов и тканей при исследовании в стандартном В-режиме и в режиме УЗ-ангиографии. На втором этапе режим сканирования переводился в трехмерный, и активировалась программа гистосканирования. Для изучения возможностей методики гистосканирования в диагностике РПЖ, нами были выделены и исследованы три группы пациентов. Первая группа включала в себя 24 добровольца (14,2%), у которых по результатам клинического обследования не было выявлено подозрение на РПЖ. Критерием включения пациентов в группу служило отсутствие повышения уровня общего ПСА, возраст до 50-ти лет, а также отсутствие клинических показаний для выполнения верификационной биопсии и отсутствие таковых в анамнезе. Все пациенты данной группы проходили общее профилактическое обследование в урологических отделениях. Средний их возраст составил 43,29+3,67 (медиана 44) лет (от 31 до 49 лет). Уровень ПСА в среднем составлял 2,38+0,97 (медиана 2,35) нг/мл (от 0,62 нг/мл до 3,92 нг/мл) и не превышал общепринятого референсного предела 4,0 нг/мл. Верификация диагноза пациентам данной группы не производилась, однако 11 (45,83%) из них было выполнено МРТ органов малого таза с целью уточнения основного диагноза в рамках общего обследования. Вторая группа состояла из 29 (17,16%) пациентов с ранее верифицированным диагнозом РПЖ. Пациенты данной группы поступили в стационар для лечения по поводу установленного заболевания. Пациенты были отобраны таким образом, что биопсии выполнялись за 1-2 месяца до проведения гистосканирования. Таким образом, пациенты этой группы на момент исследования не проходили какого-либо лечения по поводу установленного заболевания. Средний возраст пациентов второй группы составил 72,41+6,36 (медиана 73) года (от 58 до 85 лет). Уровень ПСА в среднем был – 48,56+56,68 (медиана 14,1) нг/мл (от 3,69 нг/мл до 350,0 нг/мл). Также нами было обследовано 116 (68,63%) из 169 пациентов с клиническим подозрением на наличие РПЖ. Эти пациенты представили основную, третью группу исследуемых. Всем им была выполнена трансректальная мультифокальная биопсия предстательной железы. Возраст пациентов третьей группы составлял от 49 до 98 лет (средний возраст 68,0+7,34 (медиана 66,5) лет). Средний уровень общего ПСА пациентов третьей группы составил 11,54+7,69 (6,7) нг/мл (от 4,19 до 100,0 нг/мл). Диагностическим методом, используемым для верификации диагноза рака простаты, в нашем исследовании являлись данные патоморфологического исследования, полученные в ходе выполнения трансректальных мультифокальных прицельных биопсий простаты. С целью верификации диагноза РПЖ 116-ти (100%) пациентам 3-ей группы была выполнена трансректальная мультифокальная биопсия простаты под ультразвуковым наведением с учетом данных В-режима и результатов гистосканирования. Забор биопсийного материала проводился не только из стандартных точек пунктирования: 2-3 столбика ткани получали дополнительно, прицельно ориентируясь на локализацию участков на трехмерной модели органа. Таким образом, мы получали максимальный забор опухолевых клеток и минимизировали риск получения ложноотрицательного результата. Результаты и их обсуждение: При исследовании пациентов первой группы в стандартном В-режиме с применением УЗ-ангиографии у 21 пациента участков измененной эхогенности и зон измененной васкуляризации выявлено не было; у 3-х пациентов определялись участки измененной эхо-структуры, в 1 случае – с измененной васкуляризацией. Наличие аденоматозных изменений центральной части ПЖ было клинически установлено у 14 пациентов; у остальных 10 имели место клинические признаки хронического простатита. По результатам гистосканирования у 5 (20,83%) пациентов отсутствовали участки сигнала повышенной интенсивности, на трехмерной модели ПЖ зон красного цвета не отображалось. У остальных 19 (79,16%) пациентов данной группы на трехмерной модели и на всех трех проекциях простаты отображались участки красного цвета, расположенные в различных анатомических областях железы. Всего подобных участков было выявлено 23. Объем выявленных участков повышенной интенсивности варьировал от 0,02 куб. см до 6,93 куб.см, и в среднем составлял 0,69 куб.см. (Рис.2) У 17 пациентов объемы выявленных зон повышенной интенсивности не превышали референсного предела в 0,5 куб.см.; у двух пациентов были выявлены участки сигнала повышенной интенсивности, по объему сильно превалирующие над референсным пределом – объемы данных участков составляли 1,24 и 6,93 куб.см. Клинически у данных 2 пациентов было подтверждено наличие острого простатита. Таким образом, в случае отсутствия патологических изменений простаты при гистосканировании, в подавляющем большинстве случаев участков объемом более 0,5 куб.см. не определяется. Основу для изучения семиотики злокачественных новообразований со стороны тканей предстательной железы составили пациенты с гистологически подтвержденным раком. При обследовании пациентов второй группы с верифицированным диагнозом РПЖ в В-режиме гипоэхогенные участки визуализировались у 22 из 29 пациентов (75,86 %). При гистосканировании у всех (100%) пациентов на трехмерных срезах отображались участки сигнала патологической интенсивности, по своему объему превышающие референсный предел в 0,5 куб.см. В среднем их объем составил 1,76+0,93 (медиана 1,18) куб.см (от 0,63 куб.см до 6,9 куб.см). Биопсийные исследования простаты у всех пациентов второй группы проводились до исследования в режиме гистосканирования. Таким образом, выполняя ультразвуковое исследование, мы заведомо знали, что у обследуемых пациентов гистологически подтверждено наличие опухолевого заболевания простаты. РПЖ имел строение аденокарциномы разной степени дифференцировки: высокодифференцированная аденокарцинома выявлена у 14 (48,27%) пациентов, умеренно-дифференцированная – у 11 (37,9%), низкодифференцированная аденокарцинома – у 4 (13,8%) пациентов. Результаты исследования пациентов с верифицированным диагнозом РПЖ показали 100% чувствительность методики гистосканирования в выявлении опухолевых очагов. Полученные результаты позволяют рассматривать данную методику в качестве надежного критерия, свидетельствующего о наличии опухолевого процесса. При обследовании пациентов третьей группы с подозрением на РПЖ у 62 (53,45%) пациентов в В-режиме было выявлено 73 участка измененной эхогенности и эхо-структуры. У 59 (50,86%) пациентов данные серой шкалы и УЗ-ангиографии позволяли однозначно сделать заключение о наличии РПЖ, у остальных 3 (2,58%) пациентов результаты сканирования в В-режиме представлялись сомнительными и носили предположительный характер. При гистосканировании у 72 (62,07%) пациентов было выявлено наличие участков патологической интенсивности, объем которых превышал референсный предел 0,5 куб.см. В общей сложности было выделено 91 участков патологической интенсивности. По данным гистосканирования у 29 (25,0%) пациентов патологические сигналы были выявлены в одной из долей предстательной железы, двустороннее расположение участков отмечалось у 40 (34,48%) пациентов. Объем выявленных патологических участков варьировал от 0,51 куб.см. до 12,0 куб.см, в среднем составляя 1,89+1,19 (1,32) куб.см. По результатам исследования в В-режиме и УЗ-ангиографии, истинно положительные заключения получены у 38 (32,75%) из 116 обследованных пациентов, ложноотрицательные – у 17 (14,65%), ложноположительные – у 21 (18,1%), истинно отрицательные – у 40 (34,48%). При гистосканировании было получено 51 (43,96%) истинно положительное заключение, 37 (31,89%) истинно отрицательных. Ошибочные заключения наблюдались у 28 (24,13%) пациентов: у 6 (21,43%) из них были ложноотрицательными и у 22 (78,57%) – ложноположительными. Данные гистосканирования соответствовали патоморфологическому заключению у 88 (75,86%) из 116 пациентов. Немаловажно, что даже без значимого повышения уровня ПСА и отсутствия очаговых изменений в В-режиме, у 38 (45,24%) пациентов 3 группы при использовании гистосканирования был выявлен и гистологически верифицирован рак предстательной железы. Радикальная простатэктомия были выполнена 20 пациентам третьей группы. В результате проведенного анализа, была получена высокая корреляция по локализации патологических участков при гистосканировании и патоморфологических данных после РПЭ. Полное совпадение по локализации опухолевых очагов мы наблюдали у 82% пациентов, у 18% - результаты патоморфологических исследований показали больший объем и распространенность процесса, при сравнении с данными гистосканирования. Важно отметить, что применение методики гистосканирования позволило выявить 14 участков патологической интенсивности, распространяющихся на центральную часть предстательной железы, не визуализируемых в режиме В и УЗ-ангиографии. 12 из 14 определенных нами патологических участков соответствовали гистологическим заключениям о наличии клеток аденокарциномы (по результатам постбиопсийных исследований). Таким образом, чувствительность гистосканирования в выявлении раковых клеток в центральной части простаты по результатам проведенного анализа составила 85,71%. Сравнительный анализ диагностической эффективности показал, что включение в комплексное УЗИ+УЗА гистосканирования, при диагностике рака простаты, позволило повысить чувствительность метода с 69,09% до 87,72%, точность с 67,24% до 75,86%, прогностичность положительного результата с 64,4% до 69,86%, прогностичность отрицательного результата с 70,17% до 86,04%. При этом специфичность исследования существенно не изменилась: для В-режима показатель специфичности составил 65,57%, для гистосканирования - 62,71% соответственно. Согласно проведенному исследованию, применение методики гистосканирования позволило выявить большее количество опухолевых очагов простаты в отличие от ультразвукового исследования в В-режиме и УЗ-ангиографии (р< 0,005), что явилось значимым и достоверным результатом исследования. Так, включение методики гистосканирования в комплексное ультразвуковое исследование пациентов третьей группы с подозрением на рак, позволило выявить на 13 больше истинно положительных заключений при сравнении с исследованием в В-режиме. Важно отметить, что большее число истинно положительных заключений (30) было получено нами у пациентов с уровнем ПСА, находящимся в т.н. «серой зоне» - от 4 до 10 нг/мл, тогда как у пациентов с уровнем ПСА, составляющим более 10 нг/мл подобных заключений нами было выявлено 21. Методика В-режима и УЗ-ангиографии показала значительно меньшую информативность: число истинно положительных заключений составило 38, 23 из них было получено у пациентов с уровнем ПСА от 4 до 10 нг/мл, и 15 у пациентов с уровнем ПСА более 10 нг/мл. Помимо этого, использование гистосканирования позволило сократить ложноотрицательные заключения на 9,48 %. Заключение. Проведенное исследование показало, что гистосканирование, являясь самостоятельной высокочувствительной методикой, имеет высокую информативность в первичной диагностике заболеваний предстательной железы, что диктует необходимость включения этой методики в общий алгоритм обследования пациентов с подозрением на РПЖ. Включение методики гистосканирования в диагностический комплекс обследования пациентов с подозрением на РПЖ достоверно повышает чувствительность ультразвукового исследования в В-режиме и УЗ - ангиографии с 69,09 до 87.7% (p=0,001), предсказуемость отрицательного теста с 70,0 до 86,0% (p<0,003). Для достоверной оценки наличия опухолевого процесса в простате следует считать референсный критерий объема патологического участка, составляющий 0,5 куб.см. Гистосканирование является ценной дополнительной методикой, способной выявить наличие опухоли в центральной части простаты на фоне аденоматозных изменений. Наиболее целесообразно, на наш взгляд, использовать эту методику при обследовании пациентов с повышенным уровнем ПСА (особенно при его значениях, находящихся в пределах т.н. «серой зоны») при отсутствии четкой эхографической информации при стандартном ТРУЗИ и перед проведением повторных биопсий. Данные литературы и наш собственный опыт показал, что применение гистосканирования в комплексе с другими ультразвуковыми методиками в перспективе позволяет поднять качество как первичной, так и дифференциальной диагностики рака предстательной железы на более высокий, качественно новый уровень. Список литературы 1.Асланиди И.П., Пурсанова Д.М., Мухортова О.В. и соавт. Роль ПЭТ/КТ с 11C-/18F-холином в ранней диагностике прогрессирования рака предстательной железы. // Медицинская радиология и радиационная безопасность. - 2014. - N 5. - С.37-54. 2.Гажонова В.Е., Платицын И.В., Кислякова М.В. Комплексная магнитно-резонансная и ультразвуковая диагностика рака предстательной железы. // Кремлевская медицина. - 2004. - №1. - С. 15-19. 3. Гажонова В.Е. Новые ультразвуковые технологии в диагностике и в мониторинге лечения рака предстательной железы: дис. докт. мед. наук: 14.01.13 / Гажонова Вероника Евгеньевна. - М., 2002. - С. 112-123. 4. Гажонова В.Е., Кислякова М.В. Значение ТРУЗИ с УЗ-ангиографией в дифференциальной диагностике гипоэхогенных участков предстательной железы. // Материалы съезда Диагностических центров. - М. - 1999. - С. 53-56. 5. Гажонова В.Е. Новые ультразвуковые технологии в диагностике и в мониторинге лечения рака предстательной железы: дис. докт. мед. наук: 14.01.13 / Гажонова Вероника Евгеньевна. - М., 2002. - С. 112-123. 6. Зубарев A.B., Алферов С.М., Панфилова Е.А. Соноластография в диагностике рака простаты. // Кремлевская медицина. - 2009. - №3 - С. 28-31. 7. Зубарев A.B., Гажонова B.E., Чуркина С.О., Хохлова Е.А., Панфилова Е.А. Методические рекомендации по использованию инновационного метода соноэластографии для поиска рака различных локализаций. // Методическое руководство. - 2009. - Москва - С. 32. 8. Зубарев А. В., Фёдорова А. А., Чернышев В. В. Применение эхоконтрастных препаратов в клинике и перспективы синхронизации УЗИ, КТ- и МРТ-изображений (собственный опыт и обзор литературы). // Медицинская визуализация. - 2015. - №1. - С. 94-115. 9. Зубарев А.В. Ультразвуковая диагностика сегодня. // Радиология - практика. - 2005. - №4. – С. 30-32. 10. Зубарев А.В., Фёдорова А.А. Гистосканирование – новый взгляд на диагностику рака предстательной железы. // Поликлиника. -2014. - № 3. - С. 40-41. 11. Матякин Г.Г., Чуприк-Малиновская Т.П., Карякин О.Б. Лучевая терапия рака предстательной железы. // М.: ООО «МК». - 2010. - С. 9-30. 12. Trabulsi E.J., Sackett D., Gomella L.G. et al. Enhanced transrectal ultrasound modalities in the diagnosis of prostate cancer. // Urology. - 2010. - 76. - Р. 1025-33. 13. Wink M., Frauscher F., Cosgrove D. et al. Contrast enhanced ultrasound and prostate cancer; a multicentre European research coordination project. // Eur. Urol. - 2008. - 54. - Р. 982-93.
6 ноября 2016 г.
Ещё больше полезной информации на нашем Телеграм-канале