Дифференциальная диагностика пигментных опухолей средней черепной ямки, а именно между метастатической меланомой основания черепа и меланотической шваноммой черепных нервов является сложной задачей. Метастазы меланомы – проявление четвертой (терминальной) стадии онкологического процесса, в то же время лишь 10% МШ являются злокачественными, а в большинстве случаев МШ – доброкачественная опухоль, не требующая после радикальной операции никакого другого лечения и обладающая благоприятным прогнозом.
Меланотическая шванома (МШ) – редкая опухоль. В литературе описано чуть более 100 случаев МШ, среди которых поражение корешка тройничного нерва и Гассерова узла встречалось только у трех больных. Крайне редки метастазы меланомы в основание черепа (6 наблюдений) и в краниальные нервы (8 случаев). Средний возраст больных с интракраниальнами метастазами меланомы составляет 53 года, в то время как пик встречаемости меланотической шванномы соответствует возрасту 30-40 лет. В 17,3% МШ содержатся псаммомные тельца, отсутствующие в меланоме. В отличие от метастазов меланомы, часто меланотическая шваннома (чаще псамоммоматозный вариант) встречается в составе аутосомно – доминантного синдромокомплекса Carney.
Помимо перечисленных отличий существуют сходства, усложняющие дифференциальную диагностику. Меланотическая шваннома и метастазы меланомы в краниальные нервы имеют схожую клиническую картину поражения соответствующего нерва.
В настоящее время выявление меланинсодержащих опухолей является несложной задачей для высокотесловой МРТ. Однако как метастазы меланомы, так и меланотическая шваннома на нативных МР – изображениях выглядят одинаково: гиперинтенсивные в T1 взвешенных изображениях и изоинтенсивные или гипоинтенсивные в T2 последовательностях (Brain Metastases). МШ могут иметь солидно – кистозный характер и гантелеобразный («песочные часы») рост, что их отличает от метастазов меланомы.
Как меланоциты, так и швановские клетки исходят из единого нервного гребня, что обуславливает гистологическое и иммуногистохимическое сходство меланоцитов и меланин содержащих швановских клеток. При отсутствии иных признаков комплекса Carney, псаммоматозных тел и первичных опухолей, дифференциальная диагностика меланотической шванномы и метастазов меланомы является задачей, решаемой только комплексным подходом.
В связи с редкостью и трудностью дифференциальной диагностики данной опухоли, приводим описание нашего наблюдения МШ корешка тройничного нерва, которое сначала морфологами было расценено как метастаз меланомы.
ОПИСАНИЕ СЛУЧАЯ
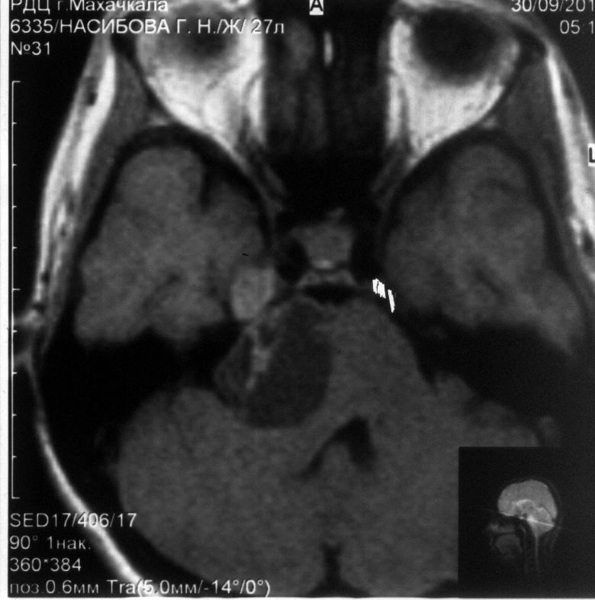
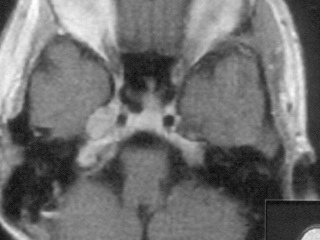
Пациентка Н., 27 лет. Поступила в НИИ НХ 10.12.2010 г. с жалобами на невозможность самостоятельно передвигаться из-за выраженной шаткости, на снижение слуха и онемение на лице справа, ухудшение речи и двоение предметов перед глазами. Из анамнеза известно, что в феврале 2010 г. заболела гриппом, последствием чего явилась правосторонняя прикорневая пневмония, была госпитализирована в стационар по месту жительства. В апреле 2010 г появилось онемение на лице справа. В мае произведена МРТ, на которой, со слов родственников, данных за опухоль не выявлено. В августе появилось двоение предметов перед глазами, а в начале сентября повысилась температура тела до 39О С. В стационаре по месту жительства, выполнена МРТ черепа, которая выявила солидно – кистозную опухоль правого мостомозжечкового угла с интракавернозным ростом (рис. 1). В T1 режиме опухоль имела гиперинтенсивный сигнал, в Т2 - изоинтенсивный. В октябре 2010 г. присоединились нарушение координации и ухудшение речи. Госпитализирована в институт нейрохирургии для хирургического лечения. 23.11.2010 г., где была проведена операция: удаление опухоли правого мостомозжечкового угла ретросигмовидным доступом. Ниже приводим протокол операции.
Парамедианный разрез мягких тканей затылочной области справа. Костнопластическая трепанация над наружными 2/3 полушария мозжечка с обнажением краёв поперечного и сигмовидного синусов. Твёрдая оболочка умеренно напряжена, она рассечена дугообразным разрезом параллельно сигмовидному синусу и прилежащим начальным отделам поперечного синуса. Ткань мозжечка умеренно напряжена, пульсация ослаблена. После выведения ликвора из большой затылочной цистерны напряжение регрессировало. Подход по задней поверхности пирамиды височной кости. Медиальнее внутреннего слухового прохода выявлена больших размеров опухоль с капсулой желтовато-серого цвета. На заднем полюсе опухоли на уровне внутреннего слухового прохода выявлены растянутые вестибулокохлеарный и лицевой нервы и передне-нижняя мозжечковая артерия. Капсула опухоли после коагуляции рассечена над внутренним слуховым проходом. Интракапсулярное содержимое имело черную окраску, тяжистое строение, была обильно васкуляризована. При срочной биопсии получен ответ «меланома». Капсула опухоли отделена от нервов, входивших во внутренний слуховой проход, по мере интракапсулярного уменьшения и коагуляции сосудов капсулы, нижние отделы опухоли отделены от каудальной группы нервов. Кверху опухоль распространялась в область вырезки намета и была связана с медиальными отделами задней поверхности пирамиды в проекции выхода корешка тройничного нерва. От опухоли отделены вена Денди, верхняя мозжечковая артерия, блоковый нерв. Над медиальными отделами капсулы выявлены множественные растянутые волокна корешка тройничного нерва. По мере отделения этих волокон и коагуляции сосудов капсулы медиальный полюс отделен от ствола. Выделенная часть опухоли иссечена до места её перехода через расширенное место входа корешка троиничного нерва в стенку кавернозного синуса, где опухоль инфильтрировала прилежащую твердую оболочку медиальных отделов задней поверхности пирамиды. Выполнен гемостаз. Ткань мозжечка пульсировала, ликвор поступал свободно. Твёрдая мозговая оболочка зашита наглухо. Швы на мягкие ткани.
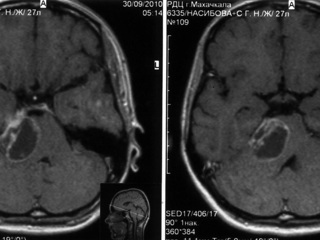
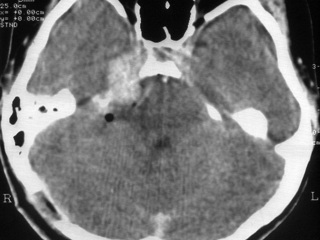
В послеоперационном периоде в неврологическом статусе отмечался грубый парез VII н справа, в остальном без отрицательной динамики. Регрессировала мозжечковая симптоматика. На серии контрольной КТ головного мозга на 6 сутки после операции, проведенной до и после введения контрастного вещества, выявляются остатки опухоли, которые в основном расположены в области кавернозного синуса справа и небольшой очаг расположен в области правого ММУ (рис 2). Через месяц после оперативного лечения пациентке, с учетом окончательного гистологического диагноза – меланома, было проведено радиохирургическое лечение на аппарате «LEKSELL GAMMA KNIFE»
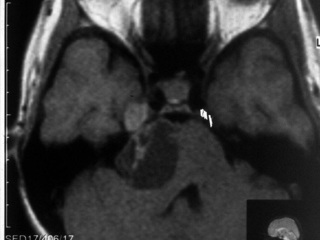
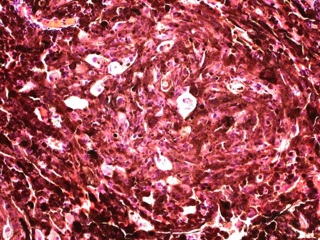
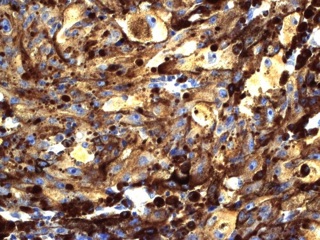
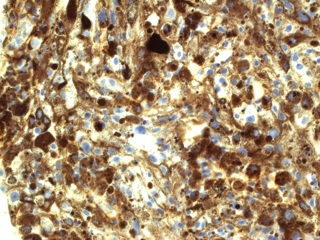
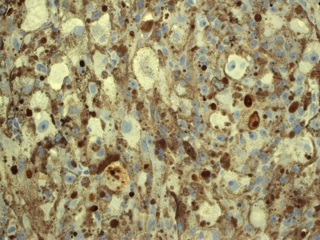
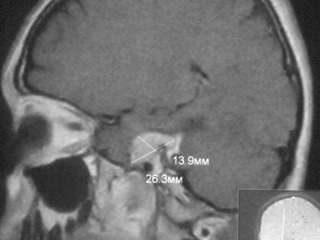
После проведенного лечения больная наблюдалась у онкологов в течение 6 месяцев. При тщательном онкологическом поиске первичный очаг не выявлен. После пересмотра гистологических препаратов и иммуногистохимического исследования установлено, что опухоль представляет из себя МШ (рис 3). Выполненная через 6 месяцев после оперативного вмешательства МР – исследование не выявило признаков роста интракавернозной части опухоли (рис 4).
ОБСУЖДЕНИЕ
Меланотическая шваннома – редкая опухоль, гистогенетически исходящая из швановских клеток оболочек периферических нервов и составляющая менее 1% первичных опухолей периферических нервов. Первое описание меланотической шваномы принадлежит Miller et all¸ описавшие поражение грудного симпатического узла в 1932 г. В 1964 г. Hodson сообщил о редкой нейрогенной опухоли, поражающей черепные нервы, алвеолярные нервы, небо, околоушную железу, шею. В настоящее время в литературе описаны 105 случаи меанотических шванном.
МШ состоят из веретенообразных и/или эпителоидных клеток с эозинофильной или амфофильной цитоплазмой с включениями меланина (меланосомы) различной степени зрелости. В 40 – 50 % случаев в клетках опухоли выявляются включения жира и псаммомные тельца, количество последних может варьировать в широких пределах. В зависимости от наличия в цитоплазме клеток псаммоматозных тел меланотические шванномы делятся на 2 группы – псаммоматозные и непсаммоматозные. Меланотические шваномы встречается спорадично (как отдельное заболевание) или являются частью комплекса Carney. В 1985 г. Carney и соавторы описали генетически обусловленный аутосмомно доминантный синдромокомплекс , который характеризуется миксомами (кожными, сердечными, грудными), пятнистой пигментацией кожи и слизистых оболочек, эндокринной гиперактивностью. В данный комплекс включаются первично пигментированное узловое адренокортикальное заболевание, вызывающее синдром Кушинга, акромегалия, вызванная СТГ – продуцирующей аденомой, опухоли яичек с кальцифицированными клетками Сертолли, аденома и карцинома щитовидной железы, кисты яичников, аденома молочных желез, остеохондромиксомы.
Последние молекулярно – генетические исследования выявили у половины больных с комплексом Carney мутацию PRKAR1A гена, кодирующего R1a регуляторную часть циклической аденозин – монофосфатзависящей протеинкиназы А. С 1990 г. известно, что более 50% описанных ПМШ выявляются в составе комплекса Carney, остальные 50% ПМШ, как и подавляющее большинство непсаммоматозных меланоцитарных шванном являются спорадической болезнью. У 10% больных с комплексом Сarney выявляется ПМШ. Описаны случаи люмбальных непсаммоматозных неврином (шванном) и одно наблюдение непсаммоматозной шванномы корешка тройничного нерва у больных с комплексом Carney. Непсаммоматозный вариант опухоли обычно поражает спинномозговые нервы и параспинальные ганглии [9], псаммоматозные МШ обнаруживается в нервах пищеварительного тракта, сердца, а также – в черепных нервах [10] [ДР]. В 20% наблюдений МШ имеют мультицентричную локализацию. Крайне редки интрамедуллярные МШ. Описаны 5 случаи интракраниальных меланотических шванном, 2 из которых исходили из вестрибулярного нерва, 3 из корешка тройничного нерва.
Меланотические шванномы бывают доброкачественные и злокачественные. Первично злокачественные МШ встречаются в 10% случаев. Гистологическими признаками злокачественности являются крупные везикулярные ядра, со скудным количеством хроматина, выраженные эозинофильные или фиолетовые макромолекулы, плеоморфизм ядер, высокая митотическая активность. Биологическое поведение меланотических шванном неоднозначное. Доброкачественные МШ без митоза, атипии или некроза имеют склонность к рецидивированию и метастазированию, в связи с чем, злокачественное течение наблюдается чаще, по сравнению с первично – злокачественными опухолями.
В большой литературной серии, представленной Killeen описываются рецидивы и метастазы в 24% и 10% случаев соответственно, с худшим прогнозом для больных при неполной резекции опухоли и при опухолях краниальных нервов. Vallet – Decouvelarere et all сообщают о 15% рецидивов и 26,3% метастазов. Вне ЦНС МШ чаще метастазируют в легкие. По данным авторов 18% данных опухолей имеют злокачественное течение, в 21,1% случаев МШ являлись причиной смерти у больных с комплексом Carney.
Метастазы меланомы в основание черепа и краниальные нервы встречаются крайне редко и имеют агрессивное течение. Средняя продолжительность жизни больных с интракраниальными метастазами в головной мозг не превышает 4 месяцев, в 94,5% случаев они являются причиной летального исхода. Тактика лечения при МШ и метастазах меланомы отличается и при метастазах краниальных нервов от путей метастазирования. Диагностика усложняется тем, что в 4,6% краниальные метастазы являются первым проявлением меланомы.
Механизм метастазирования меланомы в черепные нервы объясняется периневральным распространением опухолевых клеток. Таким путем поражаются преимущественно лицевой нерв и ветви тройничного нерва. В литературе описаны 8 случаев меланом головы и шеи с МР - подтвержденным периневральным распространением опухоли. В одном случае первично выявлена опухоль Гассерова узла, которая была оценена как меланотическая шванома. Через 9 месяцев после резекции относительно большой интракраниальной опухоли, в области гомолатеральной носогубной складки выявлена первичная опухоль - десмопластическая меланома. Выявление первичного очага и выяснение путей метастазирования важны, так как размеры и форма поля облучения при периневральном распространении должна включать весь путь от кожи до Меккелевой полости. При подозрении метастаза меланомы в краниальные нервы необходимо тщательно исследовать кожу лица с целью выявления первичного очага.
В дифференциальной диагностике МШ и метастазов меланомы важную роль играет иммуногистохимическое исследование. Иммуногистохимический профиль МШ характеризуется выраженной экспрессией маркеров как шванновской, так и меланцитарной дифференцировки, что нередко затрудняет постановку правильного диагноза [9]. Клетки МШ почти всегда позитивны к ИГХ маркерам меланомы, включая S-100, НМВ-45 и Мелан А [9, 10]. Кроме этих маркеров, иногда отмечается экспрессия глиофибриллярного белка и белка нейрофиламентов [5, 9]. Для дифференциальной диагностики с меланомой на иммуногистохимическом уровне решающую роль играют ламинин и коллаген IV типа , которые позитивны только в МШ, но не экспрессируется в злокачественной меланоме [9, 10]. В пользу злокачественности МШ говорят признаки: наличие некроза, повышенная митотическая активность и ядерная атипия [5, 6]. Последний признак скептически оценивается рядом авторов, т.к. нередко доброкачественные МШ имеют гистологически довольно «атипичный» вид [5, 6]. Наличие ядерного палисадного типа структуры, высокой клеточности, выраженных веретеновидных клеток и отсутствие первичного кожного очага может помочь в представлении диагноза ЗМШ. Электронная микроскопия помочь дифференцировать между ЗМШ и злокачественной меланомой [9]. МШ имеет выраженные межклеточные соединения в дополнение к наружной пластинке, клеточным отросткам и меланосомам на разных стадиях созревания [4] Меланома лишена истинных межклеточных соединений, имеет клеточные интердигитации и ядра ее клеток зазубренные с выраженными ядрышками [4]. Важно тщательное исследование опухоли, т.к. материал для срочного исследования берется с периферии новообразования, где чаще содержится доброкачественный на вид компонент оболочек нерва [4, 6, 9]. Таким образом, лишь тщательное гистологическое исследование в сочетании с ИГХ, а порой ЭМ позволяет достоверно дифференцировать между МШ (доброкачественной или злокачественной) и меланомой.
ВЫВОДЫ:
- Отличительными особенностями МШ являются относительно молодой возраст пациентов, наличие признаков комплекса Carneу, отсутствие первичной опухоли, наличие псаммомных телец в опухоли.
- На МР изображениях МШ и метастазы меланомы имеют схожую интенсивность сигнала ввиду наличия в них меланинсодержащих гранул. Косвенными МР признаками, свидетельствующими в пользу МШ могут быть кистозный характер опухоли и гантелеобразный рост.
- В пользу метастазов меланомы в краниальные нервы свидетельствуют возраст старше 40 лет, выявление первичной опухоли в лица в зоне иннервации пораженного нерва.
- При отсутствии указанных отличий дифференциальная диагностика проводится на основе результатов иммуногистохимического исследования и электронной микроскопии морфологического материала.
СПИСОК ЛИТЕРТАТУРЫ
1. Barnett SL, Wells MJ, et al. Perineural extension of cutaneous desmoplastic melanoma mimicking an intracranial malignant peripheral nerve sheath tumor: Case report. J. Neurosurgery 2011, May 6. Epub ahed of print
2. Brown R, Darnton S, Papadaki L. et al. A primary tumor of the oesophagus with both melanotic and schwannian differentiation. Melanocytic schwannoma or malignant melanoma? Journal of clinical pathology.- 2002.- N 53.- p. 318-20
3. Carrasco CA, Rojas – Salazar D et al. Melanotic nonpsammomatous trigeminal schwannoma as the first manifestation of the Carney complex: case report, Neurosurgery. 2006 Dec: 59(6): E1334-5
4. Carney JA .Psammomatous melanotic schwannoma. A distinctive, heritable tumor with special associations, including cardiac myxoma and the Cushing syndrome. Am J Surg Path.- 1990.- N.14 (3).- p. 206-222
5. Carney JA . The Carney complex (myxomas, spotty pigmentation, endocrine overactivity, and schwannomas). Derm Clin.-1995.- N.13 (1).- p.19-26
6. Elisabetta Marton, Alberto Feletti, Enrico Orvieto et al
Dumbbell-shaped C-2 psammomatous melanotic malignant schwannoma Case report and review of the literature, J. Neurosurgery, 2007 June 2007, Volume 6(6), 591 – 9
7. Ghadially F. Melanoma and Melanocytic Schwannoma. In: Diagnostic Ultrastructural Pathology, A Self Evaluation and Self-Teaching Manual, 2nd Ed, Butterworth-Heinemann: Boston,1998, pp.53-62
8. Hodson JJ: An intra-osseous tumor combination of biological importance—invasion of a melanotic schwannoma by an adamantinoma. J Pathol Bacteriol 82:257–266, 1961
9. John HS, James HC, Allan HF: Demographics, prognosis, and therapy in 702 patients with brain metastases from malignant melanoma. J. Neurosurgery 88: 11-20, 1998.
10. Kirschner LS, Carney JA, Pack SD, Taymans SE, Giatzakis C, Cho YS, Cho- Chung Y, Stratakis CA: Mutations of the gene encoding the protein kinase A type 1-α regulatory subunit in patients with Carney complex. Nat Genet 26:89–92, 2000.
11. Kirschner LS, Sandrini F, Monbo J, Lin JP, Carney JA, Stratakis CA: Genetic heterogeneity and spectrum of mutations of the PRKA1RA in patients with the Carney complex. Hum Mol Genet 9:3037–3046, 2000.
12. Killeen R, Davy C, Bauserman S. Melanotic Schwannoma. Cancer.- 1988.-N. 62.- p.174-184
13. Kindblom L, Meis-Kindblom J, Nelson J, Gunterberg B. Melanotic schwannoma: a clinicopathologic study of 42 cases [Abstract]// Mod Pathol.- 1995.- N..8. - p.7.
14. Marco V, Sirvent J, Alvarez Moro J et al. Malignant melanotic schwannoma fine-needle aspiration biopsy findings. Diag Cytopath.- 1998.- N. 18 (4).- p. 284-286
15. Millar W .Malignant melanotic tumor of the ganglion cells arising from the thoracic sympathetic ganglion. J of Path.- 1932.- N.35.- p.351-357
16. Scheithauer B, Louis D, Hunter S, Woodruff JM, Antonescu CR. Schwannoma. In: WHO Classification of Tumours of the Central Nervous System, Louis D, Ohgaki H, Wiestler O, Cavenee W, (eds.). IARC: Lyon. 2007, pp. 152-155
17. Scheithauer B, Woodruff J, Erlandson R. Melanotic schwannoma. In: Atlas of Tumor Pathology: Tumors of the Peripheral Nervous System, 3rd edition. Armed Forces Institute of Pathology: Washington, 1999, pp. 156-176
18. Schmitz KJ, Unkel C, Grabellus F et al. Melanotic schwannoma of the neck mimicking a malignant melanoma. Eur Arch Otorhinolaryngol. - 2005.- N. 262 (3).- p.182-185
19. Vallat-Decouvelaere AV, Wassef M, Lot G et al. Spinal melanotic schwannoma: a tumour with poor prognosis. Histopath. – 1999.- N..35 (6).- p.558-566
20. Watson JC, Stratakis CA, Bryant-Greenwood PK, et al. Neurosurgical implications of Carney complex. J of Neurosurg. – 2000.- N. 92 (3).- p. 413-418
21. Zhang HY, Yang GH, Chen HJ. Clinicopathological, immunohistochemical, and ultrastructural study of 13 cases of melanotic schwannoma. Chin Med J (Engl)- 2005.- N.118 (17).- p. 451-461
6 мая 2014 г.
Ещё больше полезной информации на нашем Телеграм-канале