Литературный обзор посвящен теоретическому обоснованию влияния напряжения сдвига (share stress) на эффективность профилактики венозных тромбоэмболических осложнений. Изучены возможные
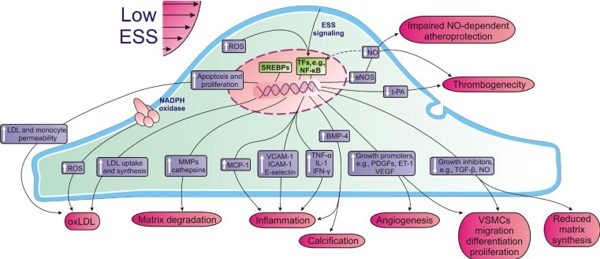
В классическом представлении напряжение сдвига (share stress) – это сила, прикладываемая к верхнему слою ламинарно текущей жидкости, вызывающая смещение нижележащих слоев относительно друг друга в направлении прикладываемой силы. При этом разность в скорости движения слоев по отношению к глубине их залегания определяется как скорость сдвига. Для ньютоновских жидкостей отношение напряжения сдвига к скорости сдвига является вязкостью среды. Более вязкой будет та жидкость, у которой большее напряжение вызывает меньшие смещения слоев относительно друг друга. Кровь, однако, не является классической ньютоновской жидкостью и ее вязкость зависит от многих прочих факторов, таких как температура, количественный и качественный состав форменных элементов, гематокритное число, скорость сдвига и прочие. Вязкость – это разновидность внутренней силы трения, возникающей между слоями движущегося потока. Между тем, кровь, движущаяся по сосуду, контактирует с эндотелием, и на границе этого взаимодействия также возникает внутреннее трение, описываемое в терминах напряжения и скорости сдвига. Эндотелий рассматривается как пласт ламинарного потока, не способный к движению вместе с кровью, но деформирующийся в ответ на воздействие. Под перманентным действием однонаправленного напряжения сдвига при ламинарном кровотоке эндотелий изменяет свою морфологию – приобретает элипсовидную форму, вытягивается в направлении движения крови, внутри клеток изменяется ориентация органелл [Dewey 1981, Helmlinger 1991, Vyalov 1996]. Поток крови деформирует эндотелиальную мембрану, что приводит к активации ионных каналов и изменению гликокаликса, белков цитоскелета, возбуждению тирозинкиназных механорецепторов на поверхности клетки [Ngai 2010]. Это потенцирует запуск систем внутриклеточных мессенджеров и синтез биологически активных веществ, оказывающих широкий спектр местных и системных регуляторных воздействий. При этом характер ответа эндотелия зависит от величины, направления и постоянства напряжения сдвига, которое напрямую связано со скоростью сдвига, скоростью потока, вязкостью крови и формой (кривизной) сосуда.
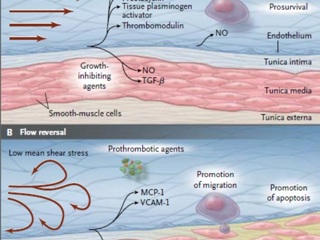
Крупные артерии характеризуются высокой линейной скоростью кровотока и высокими значениями скорости сдвига, а соответственно и высоким напряжением сдвига в пределах 10-30 дин/см2. Для крупных вен характерны более низкие значения линейной скорости кровотока, скорости сдвига и напряжения сдвига в пределах 1-6 дин/см2 [Traub 1998, Papaioannou 2005].
Наиболее глубоко эндотелиальный ответ на напряжение сдвига изучен в экспериментальных исследованиях культуры клеток внутренней оболочки пупочной вены, коронарной и сонной артерий человека и родственных животных. Научный интерес в этой области в первую очередь направлен на выявлении роли физических факторов и дисфункции эндотелия в развитии атеросклеротического процесса. Однако, учитывая универсальную роль эндотелия в регуляции сосудистого тонуса и обеспечении тромборезистентности, полученные данные могут иметь существенное значение в понимании патогенеза венозного тромбоза и эффективности методов его профилактики.
Первым механизмом тромборезистентности сосудистой стенки, на которое оказывает влияние напряжение сдвига, является целостность эндотелиальной выстилки. В отношении жизнеспособности эндотелия было показано, что физиологические и повышенные значения напряжения сдвига способны тормозить апоптоз клеток [Dimmeler 1996, Kaiser 1997] и ускорять закрытие дефекта внутренней оболочки сосуда [Vyalov 1996, Albuquerque 2000]. При этом заживление раны интимы происходит преимущественно за счет изменения формы и миграции клеток, в то время как митогенная активность эндотелия под действием напряжения сдвига подавляется вплоть до полного торможения при значениях 90 дин/см2 при постоянном и 13 дин/см2 при пульсирующем кровотоке [Levesque 1990]. Таким образом, физиологические значения напряжения сдвига позволяют поддерживать целостность интимы, являясь при этом не фактором роста, а лишь фактором «выживания» эндотелия [Traub 1998].
Вторым ангиопротективным механизмом является подверженный регуляторному воздействию напряжения сдвига синтез эндотелием веществ, обладающих дезаггрегантным и антикоагулянтным эффектом. Среди них наиболее изученным является синтез эндотелий-релаксирующего фактора (окиси азота, NO) и простагландина I2 (простациклина).
Окись азота является важным регулятором функции сосудистой стенки, обладающим антипролиферативным и вазодилатирующим [Garg 1989], тормозящим аггрегацию тромбоцитов [Radomsky 1990] и уменьшающим лейкоцитарную агрессию и миграцию [Kubes 1991] эффектами. В то время как значение двух последних в профилактике венозного тромбоза не вызывают сомнения, дилатация вен является спорным моментом. По закону неразрывности струи увеличение площади поперечного сечения сосуда приводит к уменьшению линейной скорости кровотока – т.е. к стазу крови. Несмотря на это, усиленный синтез NO в ответ на увеличение напряжения сдвига рассматривается большинством авторов как механизм тромборезистентности. В экспериментальных исследованиях показано, что напряжение сдвига способно стимулировать синтез NO эндотелиоцитами [Rubanyi 1986, Noris 1995], при этом клеточный ответ может носить двухфазный характер [Kuchan 1994]. На первом этапе происходит быстрый выброс окиси азота, не зависящий от величины напряжения сдвига, однако через некоторое время начинается вторая более длительная фаза синтетической активности, интенсивность которой зависит от величины физического воздействия.
Простагландин I2 – продукт метаболизма арахидоновый кислоты, синтезируемый главным образом эндотелиоцитами. Он обладает мощным антитромботическим, антикоагуляционным, антиадгезивным эффектом, стимулирует фибринолиз, а также способствует вазодилатации и активирует коллатеральный кровоток. Ряд экспериментов показывает, что привычный для артериального русла уровень напряжения сдвига 10-24 дин/см2 способен повышать синтез простациклина в культуре эндотелиальных клеток [Grabowski 1985, Frangos 1985, Okahara 1998]. При этом увеличение количества медиатора происходит по аналогии с оксидом азота в две фазы – ранее высвобождение в течение первых 2-х минут стимуляции [Grabovsky 1985] и последующее повышение синтеза за счет активации арахидонового каскада и повышенной экспрессии гена циклооксигеназы [Okahara 1998, Topper 1996].
Среди других механизмов тромборезистентности под действием физиологических значений напряжения сдвига (13-25 дин/см2) наблюдали усиление синтеза эндотелиальными клетками естественных антикоагулянтов и активаторов фибринолиза: ингибитора пути тканевого фактора, тромбомодулина, тканевого активатора плазминогена, и уменьшение выделения прокоагуляционных агентов: тканевого фактора, ингибитора активатора плазминогена-1 [Grabowski 2001, Diamond 1990, Malek 1994, Kawai 1997, Takada 1994].
В большинстве проведенных исследований интенсивность эндотелиальной реакции повышалась с ростом напряжения сдвига. Также была отмечена связь с характером физического воздействия. Так, в исследованиях Noris [1995] и Fragnos [1985] было продемонстрировано превосходство пульсирующего режима (аналогично крупным артериальным сосудам) над постоянным в силе эндотелиального ответа. Между тем, напряжение, характерное для турбулентного кровотока (осцилляторное в эксперименте), характеризовалась крайне низкой клеточной реакцией вплоть до полного ее отсутствия [Noris 1995, Topper 1996, Helmlinger 1995]. То есть турбулентный кровоток вследствие быстрого изменения направления и относительно невысокой величины напряжения сдвига не приводит к ангиопротективному ответу эндотелия, а наоборот потенцирует клеточную пролиферацию, апоптоз, продукцию факторов коагуляции, аггрегации и вазоконстрикции с развитием патологических изменений сосудистой стенки [Paszkowiak 2003].
Известно, что переход ламинарного тока жидкости в турбулентный происходит при превышении критического значения числа Рейнольдса, которое прямо пропорционально плотности среды, линейной скорости потока, диаметру сосуда и обратно пропорционально динамической вязкости среды [Каменский]. Зная критическую величину числа Рейнольдса, плотность крови и ее вязкость можно определить критическую скорость ламинарного потока для сосуда известного диаметра. Превышение этого показателя может приводить к появлению турбулентности и снижению напряжения сдвига, а, следовательно, уменьшать эффективность профилактических мероприятий.
Таким образом, умеренное повышение напряжения сдвига способно приводить к ангиопротективному ответу эндотелия, что может объяснить высокую эффективность методов активной механической профилактики ВТЭО. Роль интимы венозной стенки в предотвращении тромбообразования ярко демонстрируют исследования фибринолиза на фоне интермиттирующей пневмокомпрессии [Salzman 1987, Comerota 1997, Chouhan 1999, Liu 1999, Chen 2002]. В приведенных работах авторы показали активацию фибринолитической системы in vivo аналогичную реакции культуры эндотелиальных клеток при воздействии искусственного напряжения сдвига. При этом эндотелиальный ответ носил не только локальный, но и системный характер [Knight 1976, Tarnay 1980].
Список литературы:
1. Albuquerque ML, Waters CM, Savla U, Schnaper HW, Flozak AS. Shear stress enhances human endothelial cell wound closure in vitro.Am J Physiol Heart Circ Physiol. 2000 Jul;279(1):H293-302.
2. Chen LE, Liu K, Qi WN, Joneschild E, Tan X, Seaber AV, Stamler JS, Urbaniak JR. Role of nitric oxide in vasodilation in upstream muscle during intermittent pneumatic compression.J Appl Physiol. 2002 Feb;92(2):559-66.
3. Chouhan VD, Comerota AJ, Sun L, Harada R, Gaughan JP, Rao AK. Inhibition of tissue factor pathway during intermittent pneumatic compression: A possible mechanism for antithrombotic effect. Arterioscler Thromb Vasc Biol. 1999 Nov;19(11):2812-7.
4. Comerota AJ, Chouhan V, Harada RN, Sun L, Hosking J, Veermansunemi R, Comerota AJ Jr, Schlappy D, Rao AK The fibrinolytic effects of intermittent pneumatic compression: mechanism of enhancedfibrinolysis.Ann Surg. 1997 Sep;226(3):306-13; discussion 313-4.
5. Dewey CF Jr, Bussolari SR, Gimbrone MA Jr, Davies PF. The dynamic response of vascular endothelial cells to fluid shear stress.J Biomech Eng. 1981 Aug;103(3):177-85.
6. Diamond SL, Sharefkin JB, Dieffenbach C, Frasier-Scott K, McIntire LV, Eskin SG.Tissue plasminogen activator messenger RNA levels increase in cultured human endothelial cells exposed to laminar shear stress.J Cell Physiol. 1990 May;143(2):364-71
7. Dimmeler S, Haendeler J, Rippmann V, Nehls M, Zeiher AM. Shear stress inhibits apoptosis of human endothelial cells. FEBSLett. 1996;399: 71–74
8. Frangos JA, Eskin SG, McIntire LV, Ives CL. Flow effects on prostacyclin production by cultured human endothelial cells. Science. 1985 Mar 22;227(4693):1477-9
9. Garg UC, Hassid A. Nitric oxide-generating vasodilators and 8-bromo-cyclic guanosine monophosphate inhibit mitogenesis and proliferation of cultured rat vascular smooth muscle cells. J Clin Invest. 1989;83:1774-1777.
10. Grabowski EF, Jaffe EA, Weksler BB. Prostacyclin production by cultured endothelial cell monolayers exposed to step increases inshear stress. J Lab Clin Med. 1985 Jan;105(1):36-43.
11. Grabowski EF, Reininger AJ, Petteruti PG, Tsukurov O, Orkin RW.Shear stress decreases endothelial cell tissue factor activity by augmenting secretion of tissue factor pathway inhibitor.Arterioscler Thromb Vasc Biol. 2001 Jan;21(1):157-62.
12. Helmlinger G, Geiger RV, Schreck S, Nerem RM. Effects of pulsatile flow on cultured vascular endothelial cell morphology.J Biomech Eng. 1991 May;113(2):123-31.
13. Kaiser D, Freyberg MA, Friedl P Lack of hemodynamic forces triggers apoptosis in vascular endothelial cells. Biochem Biophys Res Commun. 1997 Feb 24;231(3):586-90.
14. Kawai Y, Matsumoto Y, Ikeda Y, Watanabe K. Regulation of antithrombogenicity in endothelium by hemodynamic forces.Rinsho Byori. 1997 Apr;45(4):315-20.
15. Knight MT, Dawson R. Effect of intermittent compression of the arms on deep venous thrombosis in the legs.Lancet. 1976 Dec 11;2(7998):1265-8.
16. Kubes P, Suzuki M, Granger DN. Nitric oxide: an endogenous modulator of leukocyte adhesion. Proc Natl Acad Sci U S A. 1991;88:4651-4655.
17. Kuchan MJ, Frangos JA. Role of calcium and calmodulin in flow-induced nitric oxide production in endothelial cells. Am J Physiol. 1994 Mar;266(3 Pt 1):C628-36
18. Levesque MJ, Nerem RM, Sprague EA. Vascular endothelial cell proliferation in culture and the influence of flow. Biomaterials. 1990;11: 702–707.
19. Liu K, Chen LE, Seaber AV, Johnson GW, Urbaniak JR. Intermittent pneumatic compression of legs increases microcirculation in distant skeletal muscle. J Orthop Res. 1999 Jan;17(1):88-95.
20. Malek AM, Jackman R, Rosenberg RD, Izumo S. Endothelial expression of thrombomodulin is reversibly regulated by fluid shear stress. Circ Res. 1994 May;74(5):852-60
21. Ngai C.Y., Yao X. Vascular Responses to Shear Stress: The Involvement of Mechanosensors in Endothelial Cells; The Open Circulation and Vascular Journal, 2010, 3, 85-94
22. Noris M, Morigi M, Donadelli R, Aiello S, Foppolo M, Todeschini M, Orisio S, Remuzzi G, Remuzzi A. Nitric oxide synthesis by cultured endothelial cells is modulated by flow conditions.Circ Res. 1995 Apr;76(4):536-43.
23. Okahara K, Sun B, Kambayashi J.Upregulation of prostacyclin synthesis-related gene expression by shear stress in vascularendothelial cells. Arterioscler Thromb Vasc Biol. 1998 Dec;18(12):1922-6.
24. Papaioannou TG, Stefanadis C Vascular wall shear stress: basic principles and methods. Hellenic J Cardiol. 2005 Jan-Feb;46(1):9-15
25. Paszkowiak JJ, Dardik A. Arterial wall shear stress: observations from the bench to the bedside. Vasc Endovascular Surg. 2003 Jan-Feb;37(1):47-57.
26. Radomsky MW, Palmer RMJ, Moncada S. An L-arginine/nitric oxide pathway present in human platelets regulates aggregation. Proc Natl Acad Sci U S A.1990;87:5193-5197.
27. Rubanyi GM, Romero JC, Vanhoutte PM. Flow-induced release of endothelium-derived relaxing factor. Am J Physiol. 1986 Jun;250(6 Pt 2):H1145-9.
28. Salzman EW, McManama GP, Shapiro AH, Robertson LK, Donovan AS, Blume HW, et al. Effect of optimization of hemodynamics on fibrinolytic activity and antithrombotic efficacy of external pneumatic compression. Ann Surg 1987; 206:636-41.
29. Takada Y, Shinkai F, Kondo S, Yamamoto S, Tsuboi H, Korenaga R, Ando J. Fluid shear stress increases the expression of thrombomodulin by cultured human endothelial cells. Biochem Biophys Res Commun. 1994 Dec 15;205(2):1345-52.
30. Tarnay TJ, Rohr PR, Davidson AG, Stevenson MM, Byars EF, Hopldns GR. Pneumatic calf compression, fibrinolysis, and the prevention of deep venous thrombosis. Surgery 1980; 88:489-96.
31. Topper JN, Cai J, Falb D, Gimbrone MA Jr. Identification of vascular endothelial genes differentially responsive to fluid mechanical stimuli:cyclooxygenase-2, manganese superoxide dismutase, and endothelial cell nitric oxide synthaseare selectively up-regulated by steady laminar shear stress. Proc Natl Acad Sci U S A. 1996 Sep 17;93(19):10417-22
32. Traub O, Berk BC.Laminar shear stress: mechanisms by which endothelial cells transduce an atheroprotectiveforce. ArteriosclerThrombVascBiol. 1998 May;18(5):677-85.
6 марта 2015 г.
Ещё больше полезной информации на нашем Телеграм-канале