Представлены сведения, касающиеся васкулитов центральной нервной системы (ЦНС) – тяжелых, потенциально инвалидизирующих заболеваний, которые, как правило, развиваются в результате ревматических, инфекционных, лекарственных или онкологических заболеваний. Описаны морфологические, клинические проявления основных видов васкулитов, методы диагностики и дифференциальной диагностики, принципы лечения.
The article presents the information about central nervous system (CNS) vasculitides – severe, potentially debilitating diseases, which usually develops as a result of rheumatic, infectious, drug-induced or oncological diseases. Morphological and clinical manifestations of the main types of vasculitides, as well as methods of diagnosis and differential diagnosis, and treatment principles are described. Key words: Primary central nervous system vasculitis, cerebral amyloid angiopathy, β-amyloid-associated central nervous system vasculitis
К более редким формам церебрального васкулита относят изолированные, или первичные, васкулиты ЦНС [1]. В настоящее время морфологически выделяют гранулематозный (около 50%), лимфоцитарный (около 20%) и некротизирующий (около 20%) типы первичных васкулитов ЦНС. К гранулематозным ангиитам в свою очередь относят β-амилоидассоциированный васкулит (ABRA – Amyloid Beta Related Vasculitis), который занимает промежуточное положение между разновидностью церебральной амилоидной ангиопатии (ЦАА) и первичными васкулитами ЦНС. Также к этой промежуточной группе можно отнести ЦАА, ассоциированную с воспалением (CAA-RI – Cerebral Amyloid Angiopathy-Related Inflammation) [2].
Распространенность первичного васкулита ЦНС (PACNS – Primary Angiitis of the Central Nervous System) составляет 1 на 2,4 млн человек, в то время как заболеваемость ABRA – примерно 1 на 5 млн.
К основным проявлениям ABRA относятся рецидивирующие геморрагические и ишемические инсульты, эпилепсия и выраженные когнитивные нарушения. Гистологическая картина чаще всего включает гранулематозный ангиит с поражением сосудов среднего и малого калибров, разрывы стенок сосудов с кровоизлияниями, накопление β-амилоида в стенке сосудов в твердой, мягкой мозговых оболочках и веществе головного мозга [2].
В настоящее время нет единой классификации состояний, при которых происходит отложение β-амилоида в ЦНС. Спорадическая ЦАА характеризуется отложением β-амилоида в медии и адвентиции сосудов коры и мягкой мозговой оболочки [3–7]. Амилоид, который откладывается в сосудах, имеет такой же аминокислотный состав, как и предшественник белка амилоида (39–43 аминокислоты) в амилоидных бляшках при болезни Альцгеймера.
Отложение β-амилоида в сосудах может приводить к повышенной ломкости сосудов, что ведет к разрыву сосудов и внутримозговым гематомам [3, 4]. Лобарные внутримозговые гематомы являются наиболее частыми проявлениями ЦАА, которая может сопровождаться воспалением сосудистой стенки. Это проявляется медленным снижением когнитивных функций, судорогами, головными болями и наличием гиперинтенсивных очагов в режиме T2 магнитнорезонансной томографии (МРТ), которые отвечают на лечение иммуносупрессивными препаратами [8–14].
Описано несколько разновидностей ЦАА: вариант с развитием периваскулярного воспаления без деструкции стенки сосуда, т.н. CAA-RI [11, 12], и вариант с трансмуральным, часто гранулематозным, ангиитом (ABRA) [13, 14]. Высказаны предположения, будто ABRA является вариантом в большей степени первичного васкулита ЦНС, чем церебральной ангиопатии [13, 14].
В настоящее время также отсутствует единая классификация ABRA, поэтому прогноз заболевания и отдаленные последствия не изучены. В результате одного из самых крупных ретроспективных исследований пациентов с первичными васкулитами ЦНС C. Salvarani была сделана попытка уточнить различные варианты ЦАА. Пациенты с ABRA по сравнению с больными ЦАА оказались моложе, реже имели снижение интеллекта, реже страдали от инсультов, в т.ч. геморрагических, и реже имели тяжелый неврологический дефицит. При МРТ накопление гадолиния в мягкой мозговой оболочке наблюдалось чаще у пациентов с ABRA, также у них отмечен лучший ответ на лечение и исход заболевания. Нельзя исключить, что такие результаты могут быть связаны с тем, что больных ЦАА лечили гораздо реже, чем больных ABRA. Тем не менее лучший ответ на лечение и исход при ABRA можно связать с наличием васкулита, который определяет проявления заболевания и поддается иммуносупрессивному лечению по сравнению с другими формами ЦАА, при которых отсутствует воспаление и состояние считается неизлечимым [2].
При сравнении ABRA и CAA-RI были обнаружены следующие различия. При ABRA чаще выявлялись изменения мягких мозговых оболочек в присутствии или без инфильтративных очагов в белом веществе, накапливающих контраст при МРТ. В то же время лобарные кровоизлияния и вазогенный отек в сочетании с масс-эффектом чаще обнаруживали при ЦАА. При сравнении ABRA и PACNS пациенты с ABRA были старше в момент установления диагноза, чаще страдали от снижения интеллекта и судорожных припадков при первом осмотре, реже имели гемипарезы и нарушения зрения. Уровень белка в ликворе был значительно выше у пациентов с ABRA. Ишемические инсульты встречались реже, а внутримозговые гематомы и накопление гадолиния в мягкой мозговой оболочке чаще в случае ABRA. Ответ на лечение, длительность лечения и исходы заболеваний были сопоставимыми.
Исследование С. Salvarani подтверждает результаты более ранних работ [13] о том, что ABRA и периваскулярная форма (CAA-RI) служат вариантами в большей степени PACNS, чем ЦАА, и имеют схожие механизмы развития.
Необходимо также отметить, что, несмотря на отсутствие воспаления, клинические и радиологические проявления ЦАА у отдельных пациентов во многом схожи с ABRA и CAA-RI [15, 16]. Такое сходство заболеваний может объяснить ошибочную постановку диагноза СAA-RI вместо ABRA в случаях обнаружения лишь сегментарного вовлечения артерий головного мозга при биопсии.
У одного пациента с ABRA и у одного с CAA-RI описано выявление в ликворе интратекальных аутоантител к различным формам белка амилоида (1–40 и 1–42) [17, 18]. Снижение уровня этих антител было отмечено после трех месяцев стероидной терапии наряду с клиническим и радиологическим улучшением. Данные наблюдения могут свидетельствовать о том, что воспаление, связанное с ABRA и CAA-RI, может возникать в результате иммунного ответа на отложение амилоидного белка в церебральных сосудах.
Эксперименты с лечением, направленным на активное или пассивное снижение уровня отложения амилоидного белка при болезни Альцгеймера, показали, что такое лечение приводило к менингоэнцефалиту или вазогенному отеку, вызывая клинические, рентгенологические и морфологические проявления, схожие с ABRA и CAA-RI [19, 20]. В исследовании C. Salvarani вазогенный отек, или масс-эффект, наблюдался у 22 (79%) из 28 пациентов с ABRA или CAA-RI [2]. При введении бапинезумаба (хуманизированное моноклональное антитело против амилоидного белка) также развивался вазогенный отек [20].
Клиническое наблюдение
Весной 2014 г. в клинику обратился мужчина 33 лет, армянин, работал менеджером. Причиной обращения были рецидивирующие геморрагические и ишемические инсульты головного мозга. Из анамнеза известно, что заболеванию предшествовала закрытая черепно-мозговая травма. В 2010 г. выполнена правосторонняя орхидэктомия по поводу семиномы; химиотерапия и лучевая терапия не проводились в связи с полным удалением опухоли и отсутствием метастазов. В 2012 г. лечение мерказолилом по поводу тиреотоксикоза. Семейный анамнез без особенностей. Отмечена аллергия на новокаин в виде артериальной гипотензии. Дебют настоящего заболевания состоялся осенью 2011 г., когда развился периферический парез лицевого нерва.
При МРТ патологии не выявлено. Парез самостоятельно регрессировал в течение последующих трех недель. Дальнейшее ухудшение состояния пациента возникло в том же году после повторной закрытой черепномозговой травмы, когда появилась диффузная головная боль, двоение в глазах, нарушение походки. При обследовании обнаружены застойные диски зрительных нервов по данным МРТ головного мозга, множественные мелкие кровоизлияния в области моста, глубоких отделах правой височной доли. По данным компьютерной томографии (КТ) и магнитно-резонансной ангиографии сосудов мозга стенозы не выявлены.
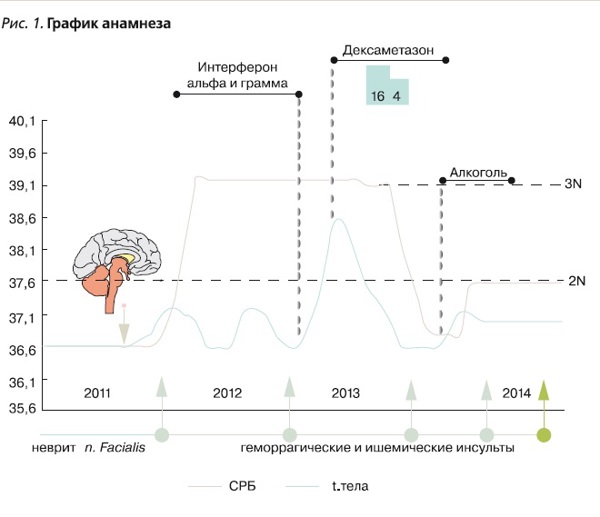
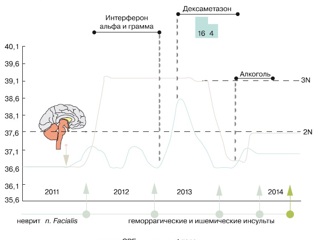
Проведено симптоматическое лечение с временным улучшением состояния и самочувствия. С мая 2012 г. вновь ухудшение состояния в виде появления сонливости, головокружения, тошноты, рвоты, субфебрилитета. Выявлено повышение уровня СРБ до 2 норм (рис. 1).
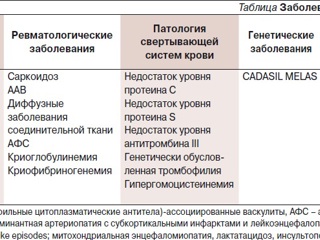
По данным МРТ, прогрессирование поражения головного мозга в виде увеличения количества мелких кровоизлияний. Дифференциальная диагностика проводилась между инфекционными заболеваниями, паранеопластическим синдромом с учетом семиномы в анамнезе, системных заболеваний соединительной ткани (см. таблицу №1).
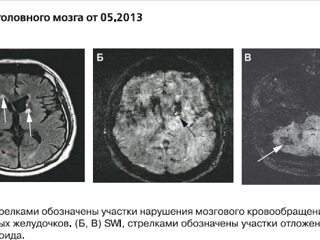
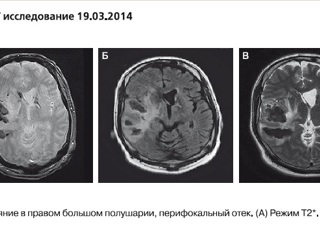
В анализах ликвора отсутствовали патологические изменения. Обсуждался постгерпетичекий геморрагический энцефалит Штрюмпеля–Ляйхтенштерна. В середине 2013 г. предпринята попытка лечения интерферонами-α и -γ, после чего состояние больного резко и выраженно ухудшилось, возникла лихорадка до 39°С, угнетение сознания до уровня сопора. При МРТ головного мозга выявлены новые кровоизлияния в сочетании с ишемическими очагами и признаками отложения амилоида (рис. 2).
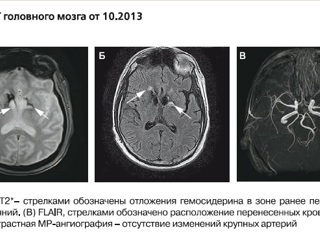
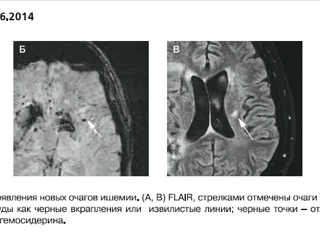
Лечение интерферонами было прекращено, начато введение дексаметазона с выраженным эффектом, пациент вернулся к повседневной жизни, нормализовались температура тела и уровень С-реактивного белка (СРБ). Через 2 месяца лечение дексаметазоном было прекращено. Следующее ухудшение – после длительного периода злоупотребления алкоголем в конце 2013 г., проявилось общей заторможенностью, нарушениями координации, психическими нарушениями в виде эпизодов неадекватности, агрессии, субфебрилитетом. По данным МРТ отмечено появление новых ишемических и геморрагических очагов в обоих полушариях головного мозга; данных о наличии интракраниальных стенозов не получено (рис. 3).
В марте 2014 г. после горячей ванны у пациента развивается крупное внутримозговое кровоизлияние в правой височной доле с признаками вклинения ствола головного мозга (рис. 4), была проведена хирургическая декомпрессия с эвакуацией гематомы. Послеоперационный период протекал без осложнений. После кровоизлияния в марте 2014 г. у пациента отсутствовали грубые двигательные и чувствительные нарушения, однако больной был инвалидизирован в связи со стойким психоорганическим синдромом, который не позволял ему вести самостоятельный образ жизни и работать.
В мае 2014 г. пациент обратился в клинику им Е.М. Тареева. При осмотре выявили субфебрилитет, умеренные когнитивные нарушения (MMSE – Mini-Mental State Examination 20 баллов), психоорганический синдром, парциальные судорожные припадки (клонусы нижней челюсти и правой стопы), инвалидизация по модифицированной шкале Рэнкина 2 балла; в соматическом статусе без особенностей. По данным МРТ, отрицательная динамика в виде появления новых ишемических очагов в обоих полушариях головного мозга (рис. 5). В анализах крови – стойкое повышение уровня СРБ до 2 норм. Заподозрен первичный васкулит ЦНС. В пользу данного диагноза свидетельствовали множественные геморрагические и ишемические очаги в головном мозге, по данным МРТ, и признаки системного воспаления в виде субфебрилитета и стойкого длительного повышения уровня СРБ. Дополнительно были исключены наследственная артериопатия (CADASIL) и митохондриальное наследственное заболевание (MELAS).
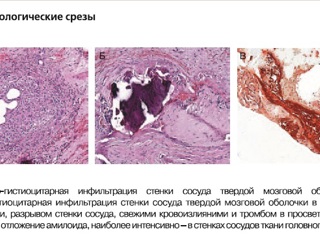
С целью подтверждения диагноза больному выполнена биопсия головного мозга в условиях отделения нейрохирургии ФГБУ "Клиническая больница №1" Управления делами Президента РФ (Волынская). Под эндотрахеальным наркозом произведен разрез по старому рубцу в правой височно-теменнозатылочной области. Кожный лоскут оттянут, костный лоскут удален. Твердая мозговая оболочка рубцово изменена, умеренно напряжена, слабо пульсирует. В проекции задних отделов нижней височной извилины выделен наиболее интактный участок твердой мозговой оболочки, иссечен на протяжении 5×5 мм, взят для исследования. После дополнительного лоскутного разреза твердой мозговой оболочки выделен интактный участок арахноидальной оболочки в малососудистой зоне, отсечен фрагмент 3×5 мм. Затем в проекции иссеченной арахноидальной оболочки острым путем иссечен фрагмент мозгового вещества 5×5 мм в глубину до 3 мм. Дефект твердой мозговой оболочки замещен фрагментом апоневроза. Костный лоскут уложен на место, фиксирован имевшимися на нем микровинтами. Рана ушита послойно. При гистологическом исследовании твердой и мягкой мозговых оболочек выявлены признаки гранулематозного деструктивного васкулита в сочетании с массивным диффузным отложением амилоида в паренхиме вещества височ. _ €ной доли большого мозга и в сосудистой стенке (рис. 6).
Таким образом, наличие гранулематозного деструктивного васкулита в сочетании с отложением амилоида позволило диагностировать первичный β-амилоид-ассоциированный васкулит ЦНС. На 4-е сутки после операции начато лечение. Проведены 3 внутривенные инфузии преднизолона по 1500 мг (из расчета 15 мг/кг массы тела) с последующим переходом на пероральный прием 75 мг/сут преднизолона. Начато лечение циклофосфамидом (ЦФ) в дозе 1400 мг внутривенно капельно 1 раз в 4 недели.
В результате лечения через месяц отмечена нормализация уровня СРБ и температуры тела, отсутствие новых повреждений головного мозга. Обсуждение Наш клинический случай служит примером длительного течения ABRA ЦНС, осложнившегося множественными ишемическими и геморрагическими инсультами, когнитивными расстройствами и эпилепсией. ABRA составляет примерно 30% всех PACNS. Данные литературы говорят о том, что ABRA является подтипом PACNS.
К основным характеристикам ABRA по сравнению с другими подтипами PACNS относятся:
• более старший возраст начала заболевания;
• частые когнитивные нарушения, судорожные припадки;
• более высокий уровень белка в ликворе;
• преобладание изменений мягкой мозговой оболочки, накапливающей контрастное вещество;
• хороший ответ на монотерапию глюкокортикодами (ГК) или в сочетании с ЦФ [21].
Необходимо отметить, что в дебюте заболевание проявлялось поражением периферической нервной системы в виде неврита лицевого нерва. В дальнейшем возникло поражение ЦНС в виде множественных ишемических и геморрагических очагов и отложения амилоида в головном мозге. Данная особенность не противоречит концепции заболевания, а по-видимому, является редким ее проявлением, т.к., с одной стороны, подобное поражение может быть проявлением гранулематозного воспаления, с другой – существуют описания сочетания поражений центральной и периферической нервной системы при PACNS [21]. К факторам риска развития васкулита у данного пациента можно отнести неоднократные травмы головы, лечение мерказолилом и злоупотребление алкоголем.
Тщательное обследование пациента с исключением обширного спектра заболеваний позволило сузить круг предполагаемой патологии до первичного васкулита ЦНС, однако несвоевременно поздно выполненная биопсия не позволила начать адекватное лечение и предотвратить инвалидизацию. Стоит также отметить, что уже на ранних МРТ головного мозга можно было заподозрить отложение амилоида, тем не менее недостаточное качество исследований и неверная трактовка результатов значительно отдалили постановку диагноза. Более того, при хирургической декомпрессии головного мозга в марте 2014 г. по поводу крупного внутримозгового кровоизлияния у молодого больного с длительным анамнезом инсультов удаленный детрит не был исследован гистологически, что потребовало в дальнейшем повторной трепанации черепа для морфологической верификации диагноза. За последние десятилетия ведутся разработки неинвазивных методов диагностики, таких как определение уровня β-амилоида в ликворе [18], позитронно-эмиссионная томография головного мозга и магнитнорезонансная спектроскопия с использованием высокопольных томографов.
Следует отметить, что МРТ с применением специальных режимов остается чувствительным методом диагностики, позволяющим заподозрить PACNS на ранних стадиях; в отсутствие изменений на МРТ диагноз первичного церебрального ангиита маловероятен [21].
При анализе МРТ головного мозга нашего пациента, в особенности последних исследований с использованием режимов FLAIR (FluidAttenuated Inversion Recovery – режим с подавлением сигнала свободной воды) и SWI (Susceptibility – Weighted Imaging – изображения, взвешенные по неоднородности магнитного поля), отчетливо видны свежие ишемические очаги (FLAIR), располагающиеся вокруг мелких сосудов (SWI), отложение амилоида и гемосидерина (SWI). Совмещение изображений разных импульсных последовательностей может давать информацию о взаимоотношении очагов ишемии и сосудов головного мозга, состоянии стенок сосудов в очаге ишемии. Несмотря на развитие неинвазивных методик, биопсия остается единственным методом достоверной диагностики ABRA. В большинстве случаев биопсия головного мозга и его оболочек – это безопасная рутинная операция.
Для снижения риска осложнений операции используют стереотаксическую навигацию с учетом расположения сосудов и проводящих путей, а также функционального картирования головного мозга [22]. Существует несколько подходов к биопсии головного мозга.
При диффузном поражении головного мозга или отсутствии возможности забора ткани из измененной области следует выполнять биопсию мягкой, твердой оболочек головного мозга, серого и белого вещества височной доли недоминантного полушария.
При наличии крупного очага или кровоизлияния предпочтительно взятие материала из пораженной области и оболочки головного мозга, в частности при проведении хирургической декомпрессии по поводу внутримозгового кровоизлияния удаленный детрит должен быть рутинно исследован на наличие амилоида (окраска конго-красным) [21].
В описанном нами случае не использовалась стереотаксическая навигация, т.к. предполагалось поверхностное взятие материала из зоны уже перенесенного крупного кровоизлияния в височной доле недоминантного правого полушария. Обычно для исследования достаточно менее 1 см2 мягкой и твердой мозговых оболочек, объем фрагмента головного мозга определяется индивидуально. Фрагменты помещают в формалин, в перечень гистологических исследований обязательно должна входить окраска на амилоид [2]. При исследовании биоптата нашего пациента наиболее выраженные изменения были выявлены в твердой мозговой оболочке и веществе головного мозга. Именно сочетание таких признаков, как трансмуральный гранулематозный ангиит с разрывом стенок сосудов, кровоизлияния и массивное отложение β-амилоида в первую очередь в стенке сосудов, позволило отнести васкулит к ABRA. В терапии ABRA используются те же подходы, что и при лечении жизнеугрожающих форм АНЦАассоциированных васкулитов: сочетание ГК и ЦФ, использование азатиоприна, препаратов микофеноловой кислоты, ритуксимаба, а также ингибиторов фактора некроза опухоли-α в отсутствие эффекта от стандартной терапии [23, 24].
Для поддержания ремиссии применяют обычно азатиоприн, микофенолат, метотрексат, ритуксимаб.
Выраженный лечебный эффект достигается от монотерапии ГК или в сочетании с ЦФ [25, 26].
Уточнение типа PACNS играет важную роль в лечении, т.к. при ABRA не рекомендовано лечение антикоагулянтами и антиагрегантами в связи с очень высоким риском геморрагических инсультов [27]. Несмотря на редкость первичных PACNS в популяции, инсульт в молодом возрасте, особенно сочетание геморрагических и ишемических очагов, эпилепсия, снижение когнитивных функций в сочетании со специфическими изменениями на МРТ всегда требуют проведения дифференциальной диагностики с PACNS. Нередко PACNS эффективно поддаются лечению, особенно на ранних стадиях, поэтому своевременная диагностика и адекватная терапия значительно снижают риск инвалидизации пациента.
Решающую роль в диагностике PACNS с поражением артерий среднего и мелкого калибра играет биопсия, которая при правильном планировании и выполнении является безопасной процедурой и должна незамедлительно использоваться при подозрении на PACNS.
Литература
1. Новиков П.И., Семенкова Е.Н., Моисеев С.В. Современная номенклатура системных васкулитов. Клиническая фармакология и терапия. 2013;1:70–4.
2. Salvarani C., Hunder G.G., Morris J.M., et al. Ab-related angiitis: Comparison with CAA without inflammation and primary CNS vasculitis. Neurology. 2013;81:1596–603.
3. Greenberg S. Cerebral amyloid angiopathy: prospects for clinical diagnosis and treatment. Neurology.1998;51:690–94.
4. Vinters H.V. Cerebral amyloid angiopathy: a critical review. Stroke. 1987;18:311–24.
5. Greenberg S.M., Vonsattel J.P.G., Stakes J.W., et al. The clinical spectrum of cerebral amyloid angiopathy: presentations without lobar hemorrhage. Neurology. 1993;43:2073–79.
6. Greenberg S.M., Gurol M.E., Rosand J., Smith E.E. Amyloid angiopathy-related vascular cognitive impairment. Stroke. 2004; 35(suppl 1):2616–19.
7. Greenberg S.M., Vonsattel J.P.G. Diagnosis of cerebral amyloid angiopathy: sensitivity and specificity of cortical biopsy. Stroke. 1997;28:1418–22.
8. Ginsberg L., Geddes J., Valentine A. Amyloid angiopathy and granulomatous angiitis of the central nervous system: a case responding to corticosteroid treatment. J. Neurol. 1988;235:438–40.
9. Fountain N.B., Eberhard D. Primary angiitis of the central nervous system associated with cerebral amyloid angiopathy: report of two cases and review of the literature. Neurology. 1996;46:190–97.
10. Schwab P., Lidov H.G.W., Schwartz R.B., Anderson R.J. Cerebral amyloid angiopathy associated with primary angiitis of the central nervous system: report of 2 cases and review of the literature. Arthritis Rheum. 2003; 49:421–27.
11. Eng J.A., Frosch M.P., Choi K., et al. Clinical manifestations of cerebral amyloid angiopathyrelated inflammation. Ann Neurol. 2004; 55:250–56.
12. Kinnecom C., Lev M.H., Wendell L., et al. Course of cerebral amyloid angiopathy-related inflammation. Neurology. 2007;68:1411–16.
13. Scolding N.J., Joseph F., Kirby P.A., et al. Ap-related angiitis: primary angiitis of the central nervous system associated with cerebral amyloid angiopathy. Brain. 2005; 128:500–15.
14. Salvarani C., Brown R.D. Jr, Calamia K.T., et al. Primary central nervous system vasculitis: comparison of patients with and without cerebral amyloid angiopathy. Rheumatology. 2008;47:1671–77.
15. Silbert P.L., Bartleson J.D., Miller G.M., et al. Cortical petechial hemorrhage, leukoencephalopathy, and subacute dementia associated with seizures due to cerebral amyloid angiopathy. Mayo Clin. Proc. 1995;70: 477–80.
16. Oh U., Gupta R., Krakauer J.W., et al. Reversible leukoencephalopathy associated with cerebral amyloid angiopathy. Neurology. 2004; 62:494–97.
17. DiFrancesco J.C., Brioschi M., Brighina L., et al. AntiAp autoantibodies in the CSF of a patient with CAArelated inflammation: a case report. Neurology. 2011;76:842–44.
18. Hermann D.M., Keyvani K., van de Nes J., et al. Brainreactive p-amyloid antibodies in primary CNS angiitis with cerebral amyloid angiopathy. Neurology. 2011;77:503–05.
19. Orgogozo J.M., Gilman S., Dartigues J.F., et al. Subacute meningoencephalitis in a subset of patients with AD after Abeta42 immunization. Neurology. 2003;61:46–54.
20. Sperling R., Salloway S., Brooks D.J., et al. Amyloid-related imaging abnormalities in patients with Alzheimer’s disease treated with bapineuzumab: a retrospective analysis. Lancet Neurol. 2012;11:241–49.
21. Salvarani C., Brown R.D. Jr, Hunder G.G. Adult primary central nervous system vasculitis. Lancet. 2012;380:767–77.
22. Hall W.A., Martin A.J., Liu H., et al. Brain Biopsy using High-Field Strength Interventional Magnetic Resonance Imaging. Neurosurgery. 1999;44(Issue 4): 807–14.
23. Новиков П.И., Моисеев С.В., Буланов Н.М., Макаров Е.А. Современные подходы к терапии АНЦА-ассоциированных системных васкулитов. Клиническая нефрология. 2014;1:42–9.
24. Моисеев С.В., Новиков П.И., Мешков А.Д., Иваницкий Л.В. АНЦА-ассоциированные васкулиты: спорные вопросы классификации, диагностики и оценки активности и современные подходы к лечению. Клиническая фармакология и терапия. 2014;1:44–50.
25. Berlit P. Diagnosis and treatment of cerebral vasculitis. Ther. Adv. Neurol. Disord. 2010;3(1):29–42.
26. Salvarani C., Brown R.D. Jr, Calamia K.T. Efficacy of tumor necrosis factor alpha blockade in primary central nervous system vasculitis resistant to immunosuppressive treatment. Arthritis Rheum.2008;59(2):291–96.
27. Mehndiratta P., Manjila S., Ostergard T., et al. Cohen M. Cerebral amyloid angiopathy– associated intracerebral hemorrhage: pathology and management. Neurosurgical Focus. 2012;32(4):E7.
К.Е. Федоров 1, Т.А. Сергиенко 2, С.С. Голубев 3, Е.В. Атясова 4, Н.А. Назарова 2, С.В. Моисеев 5, П.И. Новиков 1
- Ревматологическое отделение УКБ № 3 ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава РФ, Москва
- ФГБУ «Клиническая больница № 1» Управления делами Президента РФ (Волынская), Москва
- Московская международная лаборатория патоморфологии LABORATOIRES DE GENIE, Москва
- Отделение лучевой диагностики МЦ «Петровские ворота», Москва
- Кафедра внутренних, профессиональных болезней и пульмонологии МПФ ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава РФ
Ключевые слова: первичный васкулит центральной нервной системы, церебральная амилоидная ангиопатия, β-амилоид-ассоциированный васкулит центральной нервной системы
16 марта 2015 г.
Ещё больше полезной информации на нашем Телеграм-канале