Новая коронавирусная инфекция COVID-19 поражает не только респираторный тракт, но и опорно-двигательный аппарат, включая скелетную мускулатуру. В обзоре обобщены литературные данные, посвящённые рабдомиолизу, ассоциированному с COVID-19. Акцент в обзоре делается на возможные механизмы поражения мышц при COVID-19 и диагностические методы, включая лучевые методы диагностики.
Рабдомиолиз (РМ) является потенциально опасным осложнением, возникающим в результате как травматических, так и нетравматических этиологических факторов. Хорошо известно, что ряд вирусов, таких как вирус гриппа А и В, энтеровирусы, вирус Эпштейна-Барра и цитомегаловирус, могут вызывать РМ [1,2].
В настоящее время установлено, что коронавирусная инфекция COVID-19, вызванная вирусом SARS-CoV-2, наряду с типичными респираторными проявлениями, может иметь внелёгочные осложнения, включая поражение скелетной мускулатуры, вплоть до развития РМ.
В литературе описывается широкий диапазон проявлений РМ, начиная от бессимптомного повышения креатинфосфокиназы (КФК) и миоглобина (МГ) в сыворотке крови больных новой коронавирусной инфекцией COVID-19 до тяжёлых, фатальных осложнений, таких как острое повреждение почек (ОПП) [3,4,5].
Анализ научных публикаций показывает, что точная частота РМ у больных коронавирусной инфекцией не установлена. Среди отчётов и описаний отдельных клинических случаев РМ у больных новой коронавирусной инфекции COVID-19, интересными представляются два исследования. В 2021 году в журнале Shock были опубликованы данные китайских коллег. Y. Geng et al. (2021), которые представили когортное исследование 1014 больных новой коронавирусной инфекции COVID-19. У 22 (2,2%) больных был зафиксирован РМ. У 18 из 22 больных РМ развился после госпитализации, и средний интервал между госпитализацией и возникновением РМ составил 7,91±7,44 суток. По сравнению с больными, у которых новая коронавирусная инфекция COVID-19 протекала без повышения КФК, больший процент больных с РМ был госпитализирован в отделение реанимации и интенсивной терапии (ОРИТ) (90,9% [20/22] vs 5,3% [50/952]; Р <0,001) и нуждался в искусственной вентиляции лёгких (86,4% [19/22] vs 2,7% [26/952]; Р <0,001). Частота летальных исходов у больных с РМ была значительно выше (90,9%, 20/22), чем у больных без РМ (3,2%, 30/952). На основании полученных результатов, авторы сделали вывод о том, что больные с РМ имели более высокий риск прогрессирования заболевания вплоть до критического течения COVID-19 (балл ВОЗ 6-8). Кроме этого, больные с РМ нуждались в более частой госпитализации в ОРИТ и проведении искусственной вентиляции лёгких [4].
I. Albaba et al. (2021) представил результаты ретроспективного обсервационного исследования, в которое были включены 996 больных с COVID-19. Анализ течения заболевания показал, что у 9,2% больных наблюдался РМ, как осложнение течения основного заболевания [6].
В 2022 году в журнале Clin Exp Rheumatol был опубликован систематический обзор 1920 публикаций, посвящённых поражению мышц у больных с новой коронавирусной инфекции COVID-19, который включал 86 случаев РМ. Авторы обзора обратили внимание, что течение РМ у больных COVID-19 имеет особенности – наиболее часто РМ развивается у мужчин (77%) и в 49% случаев имеет место коморбидный фон (ожирение, сахарный диабет, гипертония). Летальность, по данным обзора литературы, составила 30% [7].
Этиологические факторы, приводящие к РМ, могут включать применение препаратов, которые обладают потенциальным миотоксическим действием, вынужденное положение больного в прон-позиции и нарушение микроциркуляции. Предполагается, что ещё одной этиологической причиной поражения мышц с развитием РМ может быть прямое цитопатическое действие вируса SARS-CoV-2 на мышцы [4].
Патогенез поражения мышц связан со способностью вируса SARS-CoV-2 внедрять свою РНК в клетку человека после взаимодействия с рецептором ангиотензинпревращающего фермента 2 (АСЕ2) [8].
Активность вируса SARS-CoV-2 зависит от двух факторов. Первым фактором является экспрессия ACE2 в клетке-хозяине для связывания с рецептором шипового домена S1. Второй фактор – это протеазы поверхности клетки-хозяина (трансмембранная протеаза серии 2 (TMPRSS2) и лизосомальные катепсины), которые используются для облегчения воздействия шипового домена S2 [9,10]. Первоначально считалось, что экспрессия TMPRSS2 имеет решающее значение для слияния мембран и окончательного проникновения вируса SARS-CoV-2 в клетки S2 [9]. Более поздние исследования показали, что вирус SARS-CoV-2 использует фурин хозяина для преактивации S1/S2, снижая зависимость вируса от клеточного TMPRSS2 и улучшая проникновение в типы клеток, демонстрирующих более низкую экспрессию TMPRSS2 [10]. Таким образом, вирус SARS-CoV-2 первоначально проникает в слизистую носа и лёгочную ткань, где происходит предварительная активация фурином клетки-хозяина во время упаковки вируса. Затем вирус SARS-CoV-2 попадает в кровоток и инфицирует ткани, богатые ACE2 и TMPRSS2, а также ткани с более низкой экспрессией TMPRSS2 [10]. Так как скелетные мышцы и другие клетки в мышцах, такие как сателлитные клетки, лейкоциты, фибробласты и эндотелиальные клетки экспрессируют АСЕ2, можно утверждать, что скелетные мышцы обладают восприимчивостью к вирусу SARS-CoV-2 через рецепторы АСЕ2 [8,11].
Кроме этого, было высказано предположение, что повреждение мышц также может возникать в результате прямого проникновении вируса в мышцы через данные рецепторы на миоцитах. В частности, прикрепление вирусного шипового белка к рецептору ACE2 может способствовать связыванию вирусной оболочки SARS-CoV-2 с мембраной клетки-хозяина с переносом генетического материала в клетку. Примечательно, что SARS-CoV-2 может быть первым вирусом, способным напрямую инфицировать мышечные волокна [12].
Способность вируса напрямую воздействовать на скелетные мышцы были подтверждены результатами патологоанатомических исследований. Так, по данным Z. Shietal. (2021) и T. Aschmanetal. (2021), у умерших от COVID-19 чаще наблюдается миозит разной степени выраженности. Вирусные частицы также были обнаружены в мышцах диафрагмы умерших больных с тяжёлой формой COVID-19 [13,14].
Вирус SARS-CoV-2 способен запускать адаптивные механизмы иммунитета. Недавно были идентифицированы 3 различных эпитопов Т-клеточных рецепторов, «высокоспецифичных» для SARS-CoV-2 (O-рибоза-метилтрансфераза, РНК-зависимая РНК-полимераза и белки экзонуклеазы 3'-к-5') у больных с дерматомиозитом. Это открытие позволило предположить, что вирус может быть триггером сверхактивации Т-лимфоцитов CD8, что приводит к поражению мышц [15]. Иммунная перекрестная реакция между вирусными антигенами и миоцитами, повреждение миоцитов в результате отложения комплексов антиген-антитело и возможная вирусная трансформация клетки хозяина или «гаптенизация» белков хозяина могут привести к нарушению регуляции иммунного ответа и повреждению мышц.
Другим иммунным механизмом является перекрёстная реактивность из-за молекулярной «мимикрии». Это приводит к атаке антителами собственных миоцитов вместо вируса [16].
В процессе репликационного цикла вирус SARS-Cov-2 вызывает повреждение и гибель инфицированных вирусом клеток и тканей, что запускает повышенную секрецию провоспалительных цитокинов. Чрезмерная продукция провосполительных цитокинов или «цитокиновый шторм» превращает защитную физиологическую реакцию организма в патологическую [17]. Избыточная продукция провоспалительных цитокинов, таких как интерлейкин-1 (ИЛ-1), ИЛ-6, фактор некроза опухоли-α, в гиперкатаболических условиях связана с окислительным стрессом, который способствует выработке агрессивных молекул, вызывающих серьезное повреждение миоцитов [18].
Основными жалобами, на основании которых можно заподозрить повреждение мышц у больных короновирусной инфекцией COVID-19, являются миалгия в сочетании с мышечной слабостью. Мышечная слабость носит симметричный характер и затрагивает, как правило, нижние конечности [16].
Диагностика РМ традиционно включает определение КФК и МГ. Это вполне объяснимо, так как они являются составной частью мышечной ткани, и их концентрация в сыворотке крови находится в прямой зависимости от степени повреждения миоцита. При повреждении мышц повышение КФК диагностируется через 12 часов и может достигать пиковой концентрации в течение 1-3 суток. Высокие значения КФК, которые часто сохраняются в течение более длительного времени, могут указывать на развитие миофасциального компартмент-синдрома или дальнейшего повреждения мышц. МГ, как продукт механического или ишемического повреждения мышц, достигает пика концентрации в сыворотке крови в течение 8-12 часов [19].
Повышение КФК у больных новой коронавирусной инфекцией COVID-19 констатируется во многих публикациях. I. Albaba et. al. (2021) исследовал концентрацию КФК в сыворотке крови у 240 из 996 больных с COVID-19. У большинства из 240 исследованных больных (86,4%) определение КФК проводилось при госпитализации в стационар и у 95,5% больных первое исследование КФК было выполнено в течение первых трёх дней после госпитализации. Авторы обнаружили, что средний уровень КФК составил 2948 МЕ/л на момент госпитализации в стационар, 3099 МЕ/л на пике и 435 МЕ/л при выписке. Показатели КФК были диагностически значимыми для верификации РМ у 72,7% исследуемых больных [6].
В другом когортном исследовании, проведённом в Китае, было выявлено повышение КФК у 13,7% больных [5].
Возвращаясь к результатам исследования Y. Geng et al. (2021), приведённым выше, у 40 (3,9%) из 1014 больных COVID-19 отмечалось повышение КФК [4].
У больных COVID-19 МГ является предиктором неблагоприятного исхода. Это было подтверждено рядом работ, в которых указывалось, что МГ может отражать тяжесть течения и прогноз у больных COVID-19 [20]. В качестве примера можно привести работу, H. Chen et al. (2021) на основании анализа течения заболевания 855 больных COVID-19 было отмечено, что МГ достоверно коррелировал с частотой развития неблагоприятного исхода (отношение рисков 1,001; 95% доверительный интервал [1,0007-1,002]; p<0,001) [21].
В настоящее время у больных в критических состояниях широко применяются лучевые методы диагностики, не стал исключением и РМ. Лучевые методы диагностики, такие как компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), ультразвуковое исследование (УЗИ) могут помочь в диагностике и оценке скелетно-мышечных симптомов COVID-19 [22].
Благодаря своей точности КТ считается «золотым стандартом» в оценке количественных и качественных изменений жировой и мышечной ткани, особенно в области туловища. КТ позволяет не только оценивать объем мышц, но и проводить качественный анализ, оценивая интенсивность жировой инфильтрации внутри мышцы (миостеатоз). КТ картина острой фазы РМ может характеризоваться периферическим усилением вокруг областей инфаркта мышечной ткани или участками некроза в виде точек или линейной формы полос вокруг измененных мышц (в англоязычной литературе - “stipple sign”) [19]. Однако, КТ не позволяет дифференцировать истинный миостеатоз от жировой ткани, расположенной между мышечных волокон. Кроме этого, применение КТ ограничено высокой стоимостью метода и лучевой нагрузкой [23].
МРТ позволяет визуализировать как поверхностные, так и глубоколежащие мышцы, дифференцировать жировую инфильтрацию и отёк. Наиболее информативными для визуализации изменений в мышцах при РМ являются режимы Т2- ВИ-SPAIR, STIR, в совокупности с DWI с факторами взвешенности b-0, b-500 и b-1000. При тяжёлом поражении мышц могут присутствовать признаки мионекроза, визуализируемые как Т2-гиперинтенсивные области по сравнению с интенсивностью сигнала соседних интактных мышц. Использование МРТ имеет ряд ограничений, связанных с тяжестью состояния больного, его транспортабельностью и коморбидной патологией [23,24].
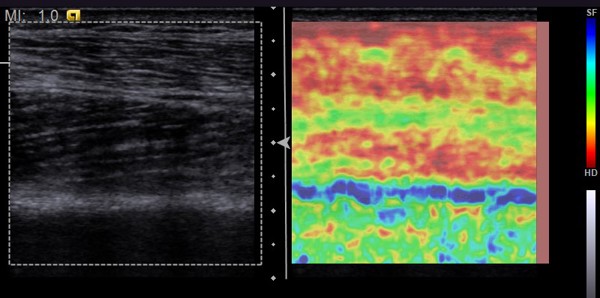
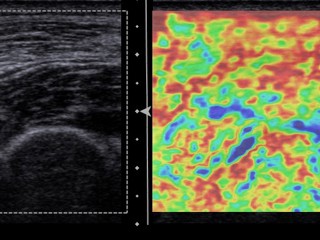
УЗИ является простым, доступным методом, не связанным с лучевой нагрузкой. Мобильная УЗИ аппаратура позволяет проводить диагностику непосредственно у постели больного в отделении интенсивной терапии, и оценивать структуру поврежденных мышц у больных РМ в режиме реального времени. Для определения эластичности/плотности мышечной ткани, оценки как качественных, так и количественных показателей плотности мышц, используются методики эластографии (ЭГ) (компрессионной и сдвиговой волны). Так, у больных РМ мышечная ткань при компрессионной ЭГ имеет мозаичное окрашивание с чередованием эластичных участков (отображающихся зелёным цветом) и высокоэластичных зон (отображающихся красным цветом), плотные зоны практически не определяются, что отображает процессы размягчения и некроза мышечной ткани.
В режиме ЭГ сдвиговой волны у больных РМ определяется снижение плотности мышечной ткани. Средний показатель плотности при РМ, соответственно нашим данным, составляет ≤1,5 м/с. Понижение плотности мышцы по данным ЭГ сдвиговой волны является следствием миолиза и воспаления, сопутствующих острой фазе РМ [19].
Правила и методы лечения больных с новой короновирусной инфекцией COVID-19, у которых диагностирован РМ, не отличаются от общих принципов терапии РМ различной этиологии. В первую очередь необходимо исключить миотоксичные препараты. С целью предупреждения ОПП, дегидратации и поддержания достаточного темпа/объёма диуреза, необходимо проводить инфузионную терапию растворами кристаллоидов. Объём инфузионной терапии должен строиться из расчёта поддержания темпа диуреза со скоростью 100-300 мл мочи/час. РМ сопровождается метаболическим ацидозом, поэтому применение натрия гидрокарбоната позволяет изменить рН выше 6,5. Щелочная среда приводит к повышению растворимости комплекса МГ-белок Тамма-Хорсфалла и предотвращению ОПП. Однако, применение натрия бикарбоната требует осторожности, так как возможно развитие парадоксального внутриклеточного ацидоза и перегрузки объёмом, особенно у больных с дыхательной или сердечной недостаточностью [25].
При развитии ОПП возникает необходимость в проведении заместительной почечной терапии. В связи с тем, что МГ имеет молекулярную массу 18 тыс. Да и низкий коэффициент диффузии применение низкопоточных (целлюлозных) диализных мембран можно считать малоэффективным. Единственной возможностью является применение мембран с высокой точкой отсечки. В литературе встречаются работы, посвящённые применению мембран с высокой точкой отсечки у больных с ОПП на фоне РМ. Однако, данные работы включают небольшие группы больных, поэтому в настоящее время ещё рано судить об их эффективности [25].
Заключение
Необходимо помнить, что РМ представляет потенциальную опасность для жизни больного в связи с фатальными осложнениями, включая ОПП. РМ может быть проявлением тяжёлого течения новой коронавирусной инфекции COVID-19. Клиницистам следует обращать внимание на такой симптом, как миалгия. Миалгия может быть ранним признаком РМ, особенно в спарке с КФК. Поэтому, необходимо уделять пристальное внимание динамическому контролю КФК у больных даже с минимальными жалобами и симптомами. Особую важность это приобретает у больных с факторами риска – пожилой возраст, мужской пол, тяжёлая коморбидная патология.
Таким образом, раннее выявление, профилактика и своевременно начатая терапия, позволят уменьшить частоту развития РМ и тем самым снизить летальность.
Литература
- Crum-Cianflone N. F. Bacterial, fungal, parasitic, and viral myositis //Clinical microbiology reviews. – 2008. – V. 21. – №. 3. – P. 473-494. doi: 10.1128/CMR.00001-08.
- Ayala E. et al. Rhabdomyolysis associated with 2009 influenza A (H1N1) //Jama. – 2009. – V. 302. – №. 17. – P. 1863-1864. doi: 10.1001/jama.2009.1582.
- Taxbro K. et al. Rhabdomyolysis and acute kidney injury in severe COVID-19 infection //BMJ Case Reports CP. – 2020. – V. 13. – №. 9. – P. 237616. doi: 10.1136/bcr-2020-237616.
- Geng Y. et al. Rhabdomyolysis is associated with in-hospital mortality in patients with COVID-19 //Shock (Augusta, Ga.). – 2021. – V. 56. – №. 3. – P. 360. doi: 10.1097/SHK.0000000000001725.
- Chedid N. R. et al. COVID-19 and rhabdomyolysis //Journal Of General Internal Medicine. – 2020. – V. 35. – №. 10. – P. 3087-3090. doi: 10.1007/s11606-020-06039-y.
- Albaba I. et al. Incidence, risk factors, and outcomes of rhabdomyolysis in hospitalized patients with COVID-19 infection //Cureus. – 2021. – V. 13. – №. 11. doi: 10.7759/cureus.19802.
- Hannah J. R. et al. Skeletal muscles and Covid-19: A systematic review of rhabdomyolysis and myositis in SARS-CoV-2 infection //Clin. Exp. Rheumatol. – 2022. – V. 40. – P. 329-338. doi: 10.55563/clinexprheumatol/mkfmxt.
- Ferrandi P. J., Alway S. E., Mohamed J. S. The interaction between SARS-CoV-2 and ACE2 may have consequences for skeletal muscle viral susceptibility and myopathies //Journal of Applied Physiology. – 2020. – V. 129. – №. 4. – P. 864-867. doi: 10.1152/japplphysiol.00321.2020.
- Hoffmann M. et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor //cell. – 2020. – V. 181. – №. 2. – P. 271-280. doi: 10.1016/j.cell.2020.02.052.
- Shang J. et al. Cell entry mechanisms of SARS-CoV-2 //Proceedings of the National Academy of Sciences. – 2020. – V. 117. – №. 21. – P. 11727-11734. doi: 10.1073/pnas.2003138117.
- De Giorgio M. R. et al. The impact of SARS-CoV-2 on skeletal muscles //Acta Myologica. – 2020. – V. 39. – №. 4. – P. 307. doi: 10.36185/2532-1900-034.
- Dalakas M. C. Guillain-Barré syndrome: The first documented COVID-19–triggered autoimmune neurologic disease: More to come with myositis in the offing //Neurology-Neuroimmunology Neuroinflammation. – 2020. – V. 7. – №. 5. doi: 10.1212/NXI.0000000000000781.
- Aschman T., Schneider J., Greuel S. Association Between SARS-CoV-2 Infection and Immune-Mediated Myopathy in Patients Who Have Died (vol 78, pg 948, 2021) //Jama Neurology. – 2021. – P. 1021-1021. doi: 10.1001/jamaneurol.2021.2004.
- Shi Z. et al. Diaphragm pathology in critically ill patients with COVID-19 and postmortem findings from 3 medical centers //JAMA internal medicine. – 2021. – V. 181. – №. 1. – P. 122-124. doi: 10.1001/jamainternmed.2020.6278.
- Megremis S. et al. Antibodies against immunogenic epitopes with high sequence identity to SARS-CoV-2 in patients with autoimmune dermatomyositis //Annals of the rheumatic diseases. – 2020. – V. 79. – №. 10. – P. 1383-1386. doi: 10.1136/annrheumdis-2020-217522.
- Saud A. et al. COVID-19 and myositis: what we know so far //Current Rheumatology Reports. – 2021. – V. 23. – №. 8. – P. 1-16. doi: 10.1007/s11926-021-01023-9.
- Singer M. et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3) //Jama. – 2016. – V. 315. – №. 8. – P. 801-810. doi: 10.1001/jama.2016.0287.
- Ali A. M., Kunugi H. Skeletal muscle damage in COVID-19: a call for action //Medicina. – 2021. – V. 57. – №. 4. – P. 372. doi: 10.3390/medicina57040372.
- Бояринцев В.В., Кутепов Д.Е., Пасечник И.Н., Фёдорова А.А. Рабдомиолиз. Междисциплинарный подход // М.: ГЭОТАР-Медиа. – 2023. – 144с.: ил. doi:10.33029/9704-7316-0-RIA-2023-I-144. [Boyarintsev V.V., Kutepov D.E., Pasechnik I.N., Fedorova A.A. Rhabdomyolysis. Interdisciplinary approach. Moscow: GEOTAR-Media. – 2023. – P.144. In Russian] doi:10.33029/9704-7316-0-RIA-2023-I-144.
- Yu J. S. et al. Myoglobin offers higher accuracy than other cardiac-specific biomarkers for the prognosis of COVID-19 //Frontiers in cardiovascular medicine. – 2021. – P. 903. doi: 10.3389/fcvm.2021.686328.
- Chen H. et al. Development and validation of a nomogram using on admission routine laboratory parameters to predict in‐hospital survival of patients with COVID‐19 //Journal of Medical Virology. – 2021. – V. 93. – №. 4. – P. 2332-2339. doi: 10.1002/jmv.26713.
- Shetty N. D. et al. Post-COVID-19 Myositis Based on Magnetic Resonance Imaging: A Case Report //Cureus. – 2022. – V. 14. – №. 10. doi: 10.7759/cureus.30293.
- Фёдорова А.А. Инструментальные методы диагностики заболеваний мышечной ткани С. 128 – 180. В книге Миопатии в практике клинициста: руководство для врачей. / Под ред. И.Н. Пасечник, С.А. Бернс, В.В. Бояринцев. // М.: ГЭОТАР-Медиа. – 2023. – 448 с. doi: 10.33029/9704-7648-2-MPK-2023-1448. [Fedorova A.A. Instrumental methods of diagnosis of diseases of muscle tissue // Myopathies in the practice of a clinician: a guide for doctors. Moscow: GEOTAR-Media. – 2023. – P. 128-180. In Russian] doi: 10.33029/9704-7648-2-MPK-2023-1448.
- Jin Q. T. Rhabdomyolysis as potential complication associated with 2019 novel coronavirus disease //Emerg. Infect. Dis. – 2020. – V. 26. doi: 10.3201/eid2607.200445.
- Кутепов Д.Е., Фёдорова А.А., Бояринцев В.В., Пасечник И.Н. Рабдомиолиз. С. 348 – 394. В книге Миопатии в практике клинициста: руководство для врачей. / Под ред. И.Н. Пасечник, С.А. Бернс, В.В. Бояринцев. // М.: ГЭОТАР-Медиа. – 2023. – 448 с.: ил. doi: 10.33029/9704-7648-2-MPK-2023-1448. [Kutepov D.E., Fedorova A.A., Boyarintsev V.V., Pasechnik I.N., Rhabdomyolysis // Myopathies in the practice of a clinician: a guide for doctors. Moscow: GEOTAR-Media. – 2023. – P. 348-394. In Russian] doi: 10.33029/9704-7648-2-MPK-2023-1448.
14 августа 2023 г.
Ещё больше полезной информации на нашем Телеграм-канале