Данная работа представляет собой систематический обзор литературы Национальной медицинской библиотеки США по теме «кардиопатии, обусловленные воздействием химиотерапии». Ключевые слова: «cardiopathy-induced chemotherapy»
Рак и сердечно-сосудистые заболевания являются двумя ведущими причинами заболеваемости и смертности на нашей планете. Примерно 17 миллионов людей во всём мире умирает от кардиоваскулярных заболеваний и 7, 6 миллионов от онкологических [1].
В настоящее время в США насчитывается более 12 миллионов онкологических больных [2]. В последнее время выживаемость таких пациентов значительно улучшилась благодаря применению современных химиопрепаратов в сочетании или без с радиационной терапией, однако, растёт частота сердечных событий, значительно ухудшающих прогноз таких пациентов. Так среди вторичных причин смертности данной группы больных кардиоваскулярные заболевания занимают первой место [3].
Кардиотоксичность химиопрепаратов является одной из основных причин смертности онкологических пациентов, в первую очередь это касается детей, пациентов с гемабластозами, больных раком молочной железы и лимфомой Ходжкина [4-6]. Она может проявляется гипертонией и разного вида аритмиями, инфарктом миокарда и внезапной сердечной смертью, бессимптомным снижением фракции выброса (ФВ) левого желудочка (ЛЖ) и клинически выраженной сердечной недостаточностью (СН) [7-14].
Первый опубликованный случай развития СН у пациента, получавшего химиотерапию датируется 1967 годом, и в настоящее время насчитывается более 40 противоопухолевых препаратов, за которыми замечен кардиотоксический эффект [2]. (Таблица 1).
Таблица 1
Кардиотоксические эффекты противоопухолевых препаратов [15-20]
Название группы | Представители | Сердечно-сосудистая токсичность |
Антрациклины | Доксорубицин | Кардиопатия в 3-26% случаев Миоперикардиты, аритмии |
Эпирубицин | Кардиопатия в 0, 9-3, 3% случаев Аритмии Тромбоэмболии | |
Идарубицин | Кардиопатия в 5-18% случаев ЭКГ-изменения | |
Митоксантрон | Кардиопатия в 0, 2-30% случаев Ишемия миокарда Гипертония | |
Алкилирующие агенты | Циклофосфамид | Кардиопатия в 7-28% случаев Пери-миокардиты Тампонада сердца Аритмии |
Изофосфамид | Кардиопатия в 17% случаев Аритмии, вплоть до асистолии Инфаркт миокарда | |
Бусольфан | Эндомиокардиальный фиброз Таммпонада сердца Аритмии Боль в груди Гипо/гипертензия Тромбозы Кардиопатия (редко) | |
Митомицин | Кардиопатия (редко) Гемоперикард, гемотампонада Ишемия миокарда Миокардит | |
Антиметаболиты | Клофарабин | Кардиопатия в 20% случаев Аритмии Гипо/гипертензия Перикардиты, тампонада серца |
5-Фторурацил | Кардиопатия в 2-20% случаев Корнароспазм Ишемия миокарда, инфаркт миокарда Желудочковые аритмии Гипотензия | |
Капецитабин | Кардиопатия в 2-7% случаев Коронароспазм, ишемия миокарда, инфаркты Тромбозы | |
Цитарабин | Перикардиты Боль в груди, стенокардия | |
Препараты платины | Цисплатин | Вазоспазм с ишемией миокарда, головного мозга, кишечника Гипо/гипертонии Аритмии Кардиопатия (редко) |
Антимикротубулярные агенты | Винкристин | Кардиопатия в 25% случаев Гипер/гипотония Ишемия миокард, инфаркт Аритмии |
Доцетаксел | Кардиопатия в 2-8% случаев | |
Паклитаксел | Гипотония Брадикардия Желудочковая тахикардия в 0, 26% случаев Внезапная сердечная смерть | |
Моноклональные антитела Блокаторы тирозинкиназы | Бевацузимаб | Кардиопатия в 1, 7-3% случаев Гипертония Артериовенозные тромбоэмболии |
Трастузумаб | Кардиопатия в 2-28% случаев Гипер/гипотонии Аритмии Тромбозы | |
Пертузумаб | Кардиопатия в 3-7% случаев | |
Алемтузумаб | Гипо/гипертония Аритмия Кардиопатия (редко) | |
Ритуксимаб | Кардиогенный шок Инфаркт миокарда [] | |
Моноклональные антитела Маломолекулярные блокаторы тирозинкиназы | Дазатиниб | Кардиопатия в 2-4% случаев Гемоперикард Гипертония Аритмия Удлинения QT-интервала |
Иматиниб мезилат | Кардиопатия в 0, 5-1, 7% случаев Гемоперикард, тампонада сердца Анасарка Аритмии Гипертония Синдром Рейно | |
Лапатиниб | Кардиопатия в 1, 5-2-2% случаев Удлинения QT-интервала Стенокардия Принцметалла | |
Сунитиниб | Кардиопатия в 3-15% случаев Гипертония Удлинение QT-интервала Расслоение аорты Артериовенозные тромбозы | |
Сорафениб | Кардиопатия в 4-28% случаев Гипертония Коронароспазм Тромбозы Ишемия/инфаркты миокарда | |
Пазопариб | Кардиопатия в 7-13% случаев Гипертония Тромбозы Ишемия/инфаркт миокарда Брадикардия Удлинение QT-интервала | |
Ингибиторы гистонодеацитилазы | Амсакрин Депсипептид Панобистат | Удлинения интервала QT Желудочковые тахикардии Внезапная сердечная смерть |
Ингибиторы протеасомы | Бортезомиб | Кардиопатия в 2-5% случаев Ишемия Брадикардия |
Прочие препараты | Ретиноидная кислота | Кардиопатия в 6% случаев Гипотония Гемоперикард Острая СН |
Пентостатин | Кардиопатия в 3-10% случаев Ишемия/инфаркты миокарда | |
Интерферон альфа - 2b | Кардиопатия в 25% случаев Гипотония Ишемия/инфаркт миокарда Внезапная сердечная смерть | |
Афиберцепт | Кардиопатия в 1-6, 8% случаев Гипертония Ишемия/инфаркт миокарда Инсульт | |
Триоксид мышьяка | Удлинения интервала QT | |
Тамоксифен | Тромбоз глубоких вен Тромбоэмболии Инсульт | |
Талидомид | Флеботромбозы Брадикардия | |
Интерлейкин-2 | Кардиопатия (редко) Гипотония Аритмия Ишемия миокарда Миокардит |
Кардиопатии, вызванные воздействие химиопрепаратов
В настоящее время не существует общепринятой классификации кардиотоксичности противоопухолевых препаратов, однако, условно её можно разделить на два типа. Кардиотоксичность I типа, обусловлена химиопрепаратами, вызывающими дозозависимое, необратимое структурное повреждение миокардиоцитов. К числу такие препаратов относятся в первую очередь антрациклины: Доксорубицин, Эпирубицин, Идарубицин, алкилирующие агенты - Циклофосфамид и антимикротубулярный препарат - Доцетаксел.
В противоположность I типу, II тип кардиотоксичности, связан с новейшими препаратами разных групп: Трастузумаб, Бевацизумаб, Лапатиниб, Синитиниб, Иматиниб и, которые способны оказывать дозонезависимые, обратимые функциональные нарушения миокарда. Оба типа кардиотоксичности могут присутствовать у одного и того же пациента [22].
Антрациклины — это антибиотики, обладающие цитостатическим действием, блокирующие синтез ДНК и РНК в быстрорастущих раковых клетках. Среди них наиболее известен Доксорубицин, который успешно используется в онкологии более 30 лет и является главным химиопрепаратом, способным вызвать терминальную СН [23].
Кардиотоксичность антрациклинов может проявляться сразу же после введения первой дозы в виде аритмий, перикардитов, миокардитов, острой СН. Большинство же кардиотоксических эффектов развиваются спустя месяцы или годы после их использования [16, 24]. Так у более 25% пациентов, получающих Доксорубицин отмечается повреждение миокарда, а у 1-4% - развитие жизнеугрожающей СН, у детей этот показатель доходит до 5, 5% [25, 26]. Доза свыше 500 мг/кг является токсичной и приводит к развитию систолической дисфункции и клинически выраженной СН с частотой 26% [] .
На основании клинических данных антрациклинновая кардиомиопатия подразделяется на острую, хроническую с ранним началом (в течение 1 года после инфузии) и хроническую с поздним началом (спустя более 1 года после инфузии).
Острая антрациклинновая кардитоксичность наблюдается в 1% случаев спустя часы или дни после инфузии, является обратимым состоянием, независящим от дозы препарата. Острое антрациклинновое повреждение миокарда не является предиктором развития СН в будущем.
Обе хронические формы являются необратимыми и дозозависимыми, поэтому очень важно максимально ограничивать суммарную дозу антрациклинновых агентов, принимая во внимание возраст пациента, его сердечно-сосудистый риск, наличие сопутствующих химиопрепаратов и лучевой терапии.
Ранние и поздние формы антрациклинновой кардиотоксичности проявляются дилатационной кардиомиопатией, а у детей могут быть признаки рестриктивной [4]. Также описаны случаи развитие под воздействие противоопухолевых препаратов острой СН по типу стресс-индуцированной кардиомиопатии Такотцубо [27, 28].
Суммарная доза менее 250 мг/м2 для детей и менее 300 мг/м2 для взрослых имеют низкий риск возникновения кардиопатии, однако возникновение её не исключается на низких дозах, если имеется полиморфизм ферментов, отвечающих за метаболизм антрациклинов, в частности карбонилредуктазы 3 [29].
Другим наиболее изученным в плане кардиотоксичности препаратом является Трастузумаб, представляющий собой рекомбинантные гуманизированные моноклональные антитела, селективно взаимодействующие с внеклеточным доменом рецептора эпидермального ростового фактора человека - 2 (HER2-рецепторами) на поверхности злокачественных клеток молочной железы и тормозящие их пролиферацию. В противоположность антрациклинам Трастузумаб не вызывает острого повреждения миокарда, а возникающее в 2-10% случаев снижение систолической функции миокарда, протекающее чаще всего бессимптомно, является обратимым. Анализ 5 рандомизированных исследований показал, что частота развития тяжёлой ХСН (III-IV классы по NYHA) на фоне приёма Трастузумаба составляет не более 4%. В отношении пожилых пациентов в возрасте от 65 до 75 лет риск развития кардиопатии и СН повышен в 2 раза по сравнению с общей популяцией [4, 30, 31 ].
Кардиопатия, вызванная воздействием химиопрепаратов, в особенности антрациклинновая, имеет худший прогноз по сравнению с другими кардиомиопатиями, ишемической или дилатационной, за счёт низкой выживаемости пациентов [32].
Патогенез
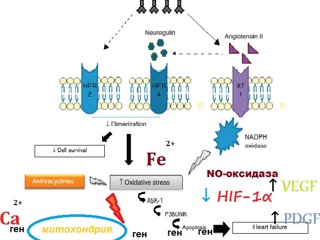
В настоящее время точный механизм развития антрациклинновой кардиопатии не известен, но её возникновение связывают с прямым действием химиопрепаратов на кардиомиоциты и их клетки-предшественники с развитием ультраструктурных повреждений таких как: деградация микрофибриллярного аппарата, вакуолизация, нарушение функции митохондрий, прямое разрушающие действие на молекулу ДНК с дезактивацией топоизомеразы 2β [29] .
Велика роль в повреждении кардиомиоцитов принадлежит свободным радикалам, чья активация приводит к запуску апоптоза опосредовано через ионы железы, кальция, NO-оксидазу, глутатион пероксидазу, нейрегулин-1, протеинкиназу В, факторы роста, цитокины и их рецепторы [32-42].
Теория оксидативного стресса в развитии Доксоциклин-индуцированной кардиопатии является наиболее популярной среди исследователей данной проблемы, и зачастую служит экспериментальной моделью для изучения причин апоптической гибели клетки и подбора средств антиоксидантной защиты [43].
Именно преждевременная гибель кардиомиоцитов, проявляющаяся развитием ХСН иногда спустя десятилетия после проведения химиотерапии, является главной целью изучения. Потеря миоцитов в результате апоптоза — основное морфологическое проявление данной токсической кардиопатии, в развитии которой задействованы практическая каждая структурно-функциональная единица клетки, начиная от огромного множества регулирующих генов, митохондрий, убиквитин-протеасомного комплекса, занимающегося внутриклеточной утилизацией метаболитов и заканчивая короткоживущими белковыми молекулами, регулирующими гомеостаз, например, такой как гипоксия-индуцируемый фактор-1, включающий во время стресса механизмы адаптации к кислородному голоданию [44-45].
Из предыдущей теории вытекает другая, согласно которой антрациклины вызывают снижения транскрипции гена TCL1A (T-cell leukemia/lymphoma 1A), являющегося коактиватором протеинкиназы В, ключевого фермента пролиферации и выживания клеток. В результате этого повышается чувствительность кардиомиоцитов к апоптозу. Вторым звеном в развитии кардиотоксичности, служит снижение экспрессии гена АВСВ 1, кодирующего мембранный белок множественной лекарственной устойчивости (Р-гликопротеин или MDR1). Данный транспортный белок способствует уменьшению внутриклеточной концентрации Доксирубицина и в случае его дефицита происходит усиление токсического действия последнего [23].
На различных животных моделях было установлено участие в развитии антрациклинновой кардиопатии таких молекул как: белок теплового шока-1, представляющий собой регулятор большого количества проапоптических генов [46], интерлейкин-1 [47], блокада рецепторов которого способствует сохранению ФВ ЛЖ после приёма Доксорубицина и резистин — гормон жировой ткани, способный оказывать прямое протективное действие на кардиомиоциты в виде увеличения захвата глюкозы и повышения сократительной функции сердца [48].
Механизмы кардитоксичности Трастузумаба также окончательно не определены, но предположительно их связывают с блокадой HER-рецепторов [49-50].
Гены нейрегулина-1 NRG и HER-рецепторы в норме играют очень важную защитную роль от оксидатного стресса, препятствую развитию апоптоза. Их блокирование Трастузумабом приводит к усилению продукции свободных радикалов и как следствие развитие апоптоза, который распространяется не только на опухолевые клетки, но и на кардиомиоциты.
Так есть исследования, показывающие улучшение систолической функции при назначении рекомбинантного человеческого нейрегулина-1. Однако, кардиотоксическое действие Трастузумаба не ограничивается только воздействием на HER-рецепторы, так на примере Лапатиниба, блокатора тирозинкиназы, было выявлено воздействие на эпидермальный фактор роста (EGF), а также возможность уменьшать токсичность Трастузумаба при их совместном применении. По другим данным Трастузумаб посредством генов BCL-X нарушает работу митохондрий и тем самым вызывает расстройство трофики и внутриклеточного транспорта [51].
На примере Иматиниба мезилата [52], ещё одного блокатора тирозинкиназы, на животной модели было впервые продемонстрировано развитие некроза кардиомиоцитов в результате повреждения структур эндоплазматического ретикулума и нарушений функций митоходрий, однако наличие кардиотоксичности у всех представителей блокаторов тирозинкиназы в настоящее время оспаривается [53, 54].
Множество патогенетических звеньев, задействованных в генезе кардиопатии, вызванной химиотерапией, с одной стороны говорит о нашей относительной безоружности против этого состояния, а с другой стороны представляет огромнейшее поле для создания целевых средств профилактического воздействия. (Рисунок 1)
Диагностика
Главная проблема онкокардиологии - это своевременное выявление признаков кардиотоксического действия химиопрепаратов. И в этой связи подсчёт ФВ ЛЖ при эхокардиографии (ЭХОКГ) должен производиться по строгим стандартам, а так как известно, что чувствительность определения ФВ ЛЖ с помощью ЭХОКГ составляет 95% с доверительным интервалом значений ±11%, то зачастую на серии эхокардиограмм малые изменения насосной функции миокарда не выявляются.
Несмотря на все недочёты, ФВ ЛЖ является проверенным временем показателем функции сердца, наиболее часто измеряемым в повседневной практике. Для повышения валидности измерения подсчёт ФВ ЛЖ производят по Симпсону, увеличивая чувствительность измерения с помощью двухмерной и/или трёхмерной ЭХОКГ.
Для точного определения дисфункции миокарда независимым комитетом по оценки сердечной деятельности (Cardiac Review and Evaluation Committee) были созданы следующие критерии, согласно которым диагноз токсической кардиопатии можно выставить, если имеется один из следующих критериев:
- Наблюдается снижение глобальной сократительной способности миокарда или локальной, касающейся перегородочных сегментов миокарда,
- Выявляются признаки СН,
- Или такие признаки как третий тон при аускультации и/или тахикардия,
- Определяется снижение ФВ ЛЖ более 5% от не менее 55%-ной исходно фракции в сочетании с клиническими признаками ХСН,
- Определяется более 10%-ное снижение ФВ ЛЖ от не менее 55%-ной исходной ФВ в отсутствие признаков ХСН.
Согласно последним рекомендациям специалистов проведение ЭХОКГ следует производить перед началом и после окончание терапии антрациклинами, а в педиатрической практике после введения каждой новой дозы. После последнего курса антрациклинов необходимо провести ЭХОКГ через 3, 6, 12 месяцев. Выявленное более чем 10%-ное снижение ФВ ЛЖ от более чем 50%-ной исходной ФВ является абсолютным критерием приостановки курса химиотерапии. Соблюдение указанных рекомендаций позволило снизить частоту развития ХСН у онкологических больных на 5% [55, 56].
Хотя по мнению других экспертов, приём антрациклинов, как наиболее мощных противоопухолевых препаратов, может быть продолжен даже в случае умеренного снижения ФВ ЛЖ до 40% [57].
В нескольких исследованиях с использованием малых групп пациентов было продемонстрирована потенциальная прогностическая ценность диастолической дисфункции миокарда, однако при дальнейшем изучении было показано, что изменение параметров наполнения ЛЖ может происходить после каждой инфузии Доксоциклина, и эти нарушения никак не коррелируют с развитием систолической дисфункции в будущем. В настоящее время ни один из показателей диастолической функции миокарда не обладает должным прогностическим значением в отношении кардиопатии.
В отношении прогностической ценности стресс-ЭХОКГ с применением физической нагрузки и добутамина так же, как и тканевой допплерографии имеются противоречивые данные, требующие дальнейшего изучения данных методик [58, 59].
Набирает обороты методика спекл-трэкинг ЭХОКГ (speckle tracking) по оценке продольной деформации миокарда в качестве ранней диагностики кардиотоксичности. Так на группе пациентов, получавших комплексную химиотерапию по поводу рака молочной железы было выявлено изменение глобальной продольной деформации миокарда, которая коррелировала с возникновением спустя 15 месяцев систолической дисфункции [60].
В отношении лабораторных показателей наибольшей прогностической ценностью обладает тропонин I, для которого на основании анализа 7 рандомизированных исследований с участием более 1500 онкологических пациентов были сформулированы следующие критерии:
определение уровня тропонина обладает мощным прогностическим значение в отношении возможного развития СН в последующие 3 месяца после проведенного курса химиотерапии,
ранее повышение концентрации тропонина может свидетельствовать о более тяжёлой систолической дисфункции,
у пациентов с сохраняющимся высоким уровнем тропонина в течение 1 месяца после последнего курса химиотерапии есть высокая вероятность развития сердечных событий в последующем году,
сохраняющийся отрицательный уровень тропонина в крови с вероятностью в 99% говорит об отсутствии сердечных осложнений в последующем году [61-65].
Натрий-уретические пептиды не имеют столь большой доказательной базы, и лишь в одном исследовании для N- концевого фрагмента proBNP найдена корреляция со снижением ФВ ЛЖ в последующие 12 месяцев после проведения химиотерапии. Однако оценку простого BNP может использовать в качестве скрининга для определения показаний к проведению ЭХОКГ [66].
В ряде работ исследуются потенциальные возможности использования в качестве биомаркёра антрациклин-индуцированной кардиопатии плазменную концентрацию гликогенфосфорилалы ВВ [67] и экспрессию гена топоизомеразы 2β [68].
В качестве дополнительных диагностических исследований химиотоксической кардиопатии рекомендуется применять однофотонную эмиссионную компьютерную томографию, магнитно-резонансную томографию сердца высокого разрешения, радионуклидную вентрикулографию, а также различных сцинтиграфические методики с использованием йобенгуана (123I MIBG) для визуализации состояния симпатической нервной системы сердца, антимиозинновых антител, меченных радиоактивным индием и аннексина с радиоактивным технецием для выявления апоптоза кардиомиоцитов [69-74].
Золотым стандартом в диагностики антрациклинновой кардиопатии остаётся эндокардиальная биопсия миокарда [75].
В случае терапии Трастузумабом большинство экспертов рекомендуют проводить ЭХОКГ до начала химиотерапии и через каждые 3 месяца, а случае исходного значения ФВ ЛЖ ниже 50% каждые 1, 5 месяца [76].
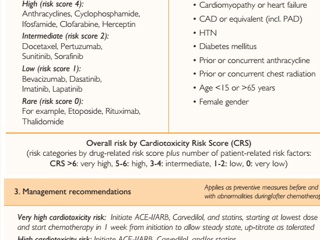
В отношении остальных противоопухолевых препаратов разработаны стратификационные таблицы, позволяющие определить общий риск кардиотоксического эффекта и составить план мониторного наблюдения и лечения (Рисунок 2). Несмотря на это в современной онкокардиологии остаются вопросы, касающиеся критериев прекращения химиотерапии и своевременного назначения лечения [56].
Стоит отдельно остановится на использовании химиопрепаратов во время беременности. Так к настоящему времени неизвестно, как беременность влияет на эффективность и токсичность различных противоопухолевых агентов. Данные регистров предполагают, что частота токсических эффектов, существенно не увеличивается во время беременности и в современной литературе нет упоминаний о повышенной частоте СН или дисфункции ЛЖ во время её протекания.
По данный ограниченного числа исследований можно предположить об относительной безопасности для матери антрациклинов во втором и третьем семестре беременности за счёт их низкой плацентарной проходимости. До сих пор нет никаких сведений о повышенном риске развития врождённых пороков сердца. На небольшой группе детей в возрасте от 9 до 29 лет, подвергнутых химиотерапии во внутриутробном периоде, было показано незначительное уменьшение толщины стенок ЛЖ со снижением его индекса массы.
При проведении антрациклинновой химиотерапии рекомендуется мониторинг ЭХОКГ матери до начала курса и после трёх доз или перед родами и проведение ультразвукового исследования плода спустя 1-2 недели после каждой инфузии препарата.
Трастузумаб к настоящему времени был проведен 15 беременным женщинам и ни у одной не произошло нормального развития плода. В связи с чем Трастузумаб противопоказан во время беременности [76].
Кардиопротекция
Современные стратегии профилактики антрациклинновой кардиотоксичности включают в себя ограничение суммарной и разовой дозы, снижение кумуляции препарата с помощью различных режимов введения, использование структурных аналогов антрациклина и липосомальных инкапсулированных форм [77-79].
Факторами риска развития антрациклинной кардиопатии являются высокие однократные дозы препаратов в сочетании с радиационной терапией, молодой возраст и женский пол.
Если дозозависимый эффект антрациклинов уже хорошо известен, то режим введения (болюсный или многодневный) у детей больных лимфобластным лейкозом не влиял на долгосрочный прогноз [80].
В качестве аналогов Доксоциклина меньшим токсическим действием на сердца обладают Эпирубицин и Идарубицин [40].
Несмотря на большое количество работ, посвящённых защите сердца при проведении химиотерапии, в настоящее время только один препарат официально используется для профилактики антрациклинновой кардиопатии — это Дексразоксон, способный нарушать формирование комплекса антрациклин-железо, предотвращать тем самым появление железосодержащих свободных радикалов, а также препятствовать дезактивации топоизомеразы 2β. Однако его применение способно снижать противоопухолевую активность, и поэтому он используется лишь в случае превышения суммарной дозы более 300 мг/м2 или во время лучевой терапии рака молочной железы [81-84].
В отношении других препаратов, способных препятствовать развитию кардиопатии или снижению ФВ ЛЖ достаточная доказательная база есть, только у Эналаприла [85-88] и Карведиола [89-93], при отдельном и совместном их применении [94]. Примечательно, что оба этих препарата оказывают именно профилактическое действие на пациентов с исходно сохранной систолической функцией, например, у детей, подвергнутых химиотерапии, поэтому в настоящее время рассматривается вопрос о превентивном приёме этих двух препаратов в случае высокого кардиотоксического риска. А это в первую очередь пациенты с наличием артериальной гипертонии и другими факторами риска сердечно-сосудистых заболеваний, которые по возможности должны быть скорректированы.
Стоит отметить, что комбинация Эналаприла и Метапролола не показала защитных качеств против доксорубицинновой кардиопатии, что связано, по видимому, с наличием у Карведиола дополнительных антиоксидантных свойств [95].
На малых выборках пациентов свою кардиопротективную эффективность также показали Валсартан и Телмисартан [96, 97].
В противоположность антрациклинам развитие Трастузумаб-индуцированной кардиопатии доставерно не связано с возрастом и классическими факторами риска ИБС, но отягощающим моментом может служить исходная систолическая дисфункция и предшествующая антрациклинновая терапия в суммарной дозе более 300 мг/м2 [98].
Для снижения кардиотоксического действия Трастузумаба существуют следующие методики:
использование Трастузумаба без предшествующего использование антрациклинов.
использование конъюгатов Трастузумаба, такого какТрастузумаб эмтанзин [51].
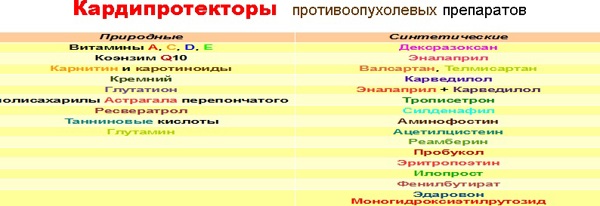
На схеме 1 [40, 99-110 ] приведены все известны препараты, обладающие противокардиопатическим действием при использовании противоопухолевой химиотерапии.
Лечение
Лечение уже сформировавшейся систолической дисфункции с или без клиники СН проводится согласно международным рекомендациям по лечению ХСН с единственным лишь дополнением о как можно более раннем применении комбинации Эналаприла и Карведиола. Данная позиция, как показывает исследование Ammon M. со авторами, пока ещё имеет малое распространение: так как менее 60% онкологических больных с ХСН получают необходимую кардиотропную терапию [111].
Обнадёживающей во всех отношениях является новость об успешном использовании внутрисердечных вспомогательных устройств для ЛЖ у пациентов с химиотерапевтической кардиопатией, ожидающих трансплантацию сердца [112].
В отношении самой трансплантации, пациенты с кардиопатией, обусловленной химиотерапией, несмотря на количественную разницу по сравнению с другими видами кардиопатий, всего лишь 0, 4% (по данным International Society of Heart and Lung Transplantation Registry), более частое использование бивентрикулярной механической поддержки кровообращения в дооперационном периоде, более высокую частоту кровотечений и инфекционных осложнений после трансплантации, имеют сходную выживаемость через 1, 3 и 5 лет, (87%, 81% и 74% соответственно) [113, 114].
Список литературы
Cardinale, D. , Colombo, A. , Torrisi, R. et al. Trastuzumab-induced cardiotoxicity: clinical and prognostic implications of troponin I evaluation. J Clin Oncol. 2010; 28: 3910–3916. http: //dx. doi. org/10. 1200/JCO. 2009. 27. 3615
Daher I. N. , Daigle T. R. , Bhatia N. , Durand J. B. The prevention of cardiovascular disease in cancer survivors. Tex Heart Inst J. 2012;39 (2): 190-8. http: //www. ncbi. nlm. nih. gov/pmc/articles/PMC3384047/
Yeh E. T. H. , Tong A. T. , Lenihan D. J. , et al. Cardiovascular complications of cancer therapy: diagnosis, pathogenesis, and management. Circulation, 109 (2004), pp. 3122–313. http: //dx. doi. org/10. 1161/01. CIR. 0000133187. 74800. B9
Felker G. M. , Thompson R. E. , Hare J. M. , et al. Underlying causes and long-term survival in patients with initially unexplained cardiomyopathy. N Engl J Med, 342 (2000), pp. 1077–1084. http: //dx. doi. org/10. 1056/NEJM200004133421502
Truong J, Yan A. T. , Cramarossa G. et. al. Chemotherapy-induced cardiotoxicity: detection, prevention, and management. Can J Cardiol. 2014 Aug;30 (8): 869-78. doi: 10. 1016/j. cjca. 2014. 04. 029.
O'Hare M, Sharma A. , Murphy K. , et. al. Cardio-oncology Part I: chemotherapy and cardiovascular toxicity. Expert Rev Cardiovasc Ther. 2015 Apr 5: 1-8. http: //dx. doi. org/10. 1586/14779072. 2015. 1027686
Kaise M. , Yoshino M. , Nagai H. et. al. Risk factors for cardiotoxicity during fluorouracil and cisplatin combination chemotherapy. Gan To Kagaku Ryoho. 2014 May;41 (5): 601-4. http: //www. pieronline. jp/content/article/0385-0684/41050/601
Roy A. , Khanna N. , Senguttuvan N. B. Rituximab-vincristine chemotherapy-induced acute anterior wall myocardial infarction with cardiogenic shock. Tex Heart Inst J. 2014 Feb;41 (1): 80-2. doi: 10. 14503/THIJ-12-2853.
House K. W. , Simon S. R. , Pugh R. P. Chemotherapy-induced myocardial infarction in a young man with Hodgkin's disease. Clin Cardiol. 1992 Feb;15 (2): 122-5. http: //dx. doi. org/10. 1002/clc. 4960150214
Law H. Chemotherapy-induced myocardial infarction. Eur Heart J. 1996 Jun;17 (6): 966-7. http: //dx. doi. org/ 966-967
Federman D. G. , Henry G. Chemotherapy-induced myocardial necrosis in a patient with chronic lymphocytic leukemia. Respir Med. 1997 Oct;91 (9): 565-7. http: //dx. doi. org/10. 1016/S0954-6111 (97) 90092-5
Abbott J. D. , Curtis J. P. , Murad K. , Kramer H. M. et. al. Spontaneous coronary artery dissection in a woman receiving 5-fluorouracil--a case report. Angiology. 2003 Nov-Dec;54 (6): 721-4. doi: 10. 1177/000331970305400613
Panella M. , Ross J. E. , Garvin K. , Martin A. J. Cardiac sudden death as a result of acute coronary artery thrombosis during chemotherapy for testicular carcinoma. Forensic Sci. 2010 Sep;55 (5): 1384-8. doi: 10. 1111/j. 1556-4029. 2010. 01437. x.
Huang C. , Zhang X. , Ramil J. M. , et al. Juvenile exposure to anthracyclines impairs cardiac progenitor cell function and vascularization resulting in greater susceptibility to stress-induced myocardial injury in adult mice. Circulation, 121 (2010), pp. 675–683. doi: 10. 1161/CIRCULATIONAHA. 109. 902221.
Gharib M. I. , Burnett A. K. Chemotherapy-induced cardiotoxicity: current practice and prospects of prophylaxis. Eur J Heart Fail. 2002 Jun;4 (3): 235-42. DOI: 10. 1016/S1388-9842 (01) 00201-X
Guglin M. , Aljayeh M. , Saiyad S. , Ali R. et. al. Introducing a new entity: chemotherapy-induced arrhythmia. Europace. 2009 Dec;11 (12): 1579-86. doi: 10. 1093/europace/eup300.
Bagnes C. , Panchuk P. N. , Recondo G. Antineoplastic chemotherapy induced QTc prolongation. Curr Drug Saf. 2010 Jan;5 (1): 93-6. DOI: 10. 2174/157488610789869111
Callaway M. P. , Tyrrell C. J. , Williams M. P. , Marshall A. J. Chemotherapy induced myocardial fibrosis. Clin Oncol (R Coll Radiol). 1994;6 (1): 55-6. http: //dx. doi. org/10. 1016/S0936-6555 (05) 80369-3
de Forni M. , Armand J. P. Cardiotoxicity of chemotherapy. Curr Opin Oncol. 1994 Jul;6 (4): 340-4.
Hong R. A. , Iimura T. , Sumida K. N. , Eager R. M. Cardio-oncology/onco-cardiology. Clin Cardiol. 2010 Dec;33 (12): 733-7. doi: 10. 1002/clc. 20823
Левчук М. Н. , Бондаренко Б. Б. Радиационные поражения сердца. Доктор. Ру №2 (80), 2013 С. 25-27.
Cardinale, D. , Colombo, A. , Torrisi, R. , Sandri, M. T. , Civelli, M. , Salvatici, M. et al. Trastuzumab-induced cardiotoxicity: clinical and prognostic implications of troponin I evaluation. J Clin Oncol. 2010; 28: 3910–3916. doi: 10. 1200/JCO. 2009. 27. 3615.
McCaffrey T. A. , Tziros C. , Lewis J. , Katz R. et. al. Genomic profiling reveals the potential role of TCL1A and MDR1 deficiency in chemotherapy-induced cardiotoxicity. Int J Biol Sci. 2013 Apr 22;9 (4): 350-60. doi: 10. 7150/ijbs. 6058.
Saidi A. , Alharethi R. Management of chemotherapy induced cardiomyopathy. Curr Cardiol Rev. 2011 Nov;7 (4): 245-9. DOI: 10. 2174/157340311799960681
Jurcut R. , Wildiers H. , Ganame J. , D'hooge J. et. al. Detection and monitoring of cardiotoxicity-what does modern cardiology offer?Support Care Cancer. 2008 May;16 (5): 437-45. doi: 10. 1007/s00520-007-0397-6.
Mulrooney D. A. , Yeazel M. W. , Kawashima T. , Mertens A. C. , et al. Cardiac outcomes in a cohort of adult survivors of childhood and adolescent cancer: retrospective analysis of the Childhood Cancer Survivor Study cohort. BMJ 2009;339: b4606. doi: 10. 1136/bmj. b4606.
Smith S. A. , Auseon A. J. Chemotherapy-induced takotsubo cardiomyopathy. Heart Fail Clin. 2013 Apr;9 (2): 233-42, x. doi: 10. 1016/j. hfc. 2012. 12. 009.
Kim L. , Karas M. , Wong S. C. Chemotherapy-induced takotsubo cardiomyopathy. J Invasive Cardiol. 2008 Dec;20 (12): E338-40.
Shah S. , Nohria A. Advanced heart failure due to cancer therapy. Curr Cardiol Rep. 2015 Apr;17 (4): 16. doi: 10. 1007/s11886-015-0570-3.
Tsai H. T. , Isaacs C. , Fu A. Z. , Warren J. L. et. al. Risk of cardiovascular adverse events from trastuzumab (Herceptin (®) ) in elderly persons with breast cancer: a population-based study. Breast Cancer Res Treat. 2014 Feb;144 (1): 163-70. doi: 10. 1007/s10549-014-2836-7.
Ewer S. M. , Ewer M. S. Cardiotoxity profile of trastuzumab. Drug. Saf. 2008; 31 (6): 459-61.
Zuppinger C. , Timolati F. , Suter T. M. Pathophysiology and diagnosis of cancer drug induced cardiomyopathy. Cardiovasc Toxicol. 2007;7 (2): 61-6. http: //dx. doi. org/10. 1007/s12012-007-0016-2
Singal PK, Deally CM, Weinberg LE. Subcellular effects of adriamycin in the heart: a concise review. J Mol Cell Cardiol. 1987 Aug; 19 (8): 817-28. DOI: http: //dx. doi. org/10. 1016/S0022-2828 (87) 80392-9.
Kwok J. C. , Richardson D. R. Anthracyclines induce accumulation of iron in ferritin in myocardial and neoplastic cells: inhibition of the ferritin iron mobilization pathway. Mol pharmacol. 2003 Apr; 63 (4): 849-61. doi: 10. 1124/mol. 63. 4. 849
Schmitz N. , Kloess M. , Reiser M. , et al. Four versus six courses of dose-escalated cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) regimen plus etoposide (MegaCHOEP) and autologous stem cell transplantation: early dose intensity is crucial in treating younger patients with poor prognosis aggressive lymphoma. Cancer, 106 (2006), pp. 136–145. DOI: 10. 1002/cncr. 21588
Kuittinen T. , Jantunen E. , Vanninnen E. , et al. Cardiac effects within 3 months of BEAC high-dose therapy in non-Hodgkin’s lymphoma patients undergoing autologous stem cell transplantation. Eur J Haematol, 77 (2006), pp. 120–127. DOI: 10. 1111/j. 1600-0609. 2006. 00687. x
Chung T. , Lim W. -C. , Sy R. et. al. Kritharides Subacute cardiac toxicity following autologous haematopoietic stem cell transplantation in patients with normal cardiac function. Heart, 94 (2008), pp. 911–918. http: //heart. bmj. com/content/94/7/911. long
Lenneman C. G. Neuregulin-1 signaling in the pathogenesis of chemotherapy-induced heart failure. Curr Heart Fail Rep. 2014 Jun;11 (2): 134-8. doi: 10. 1007/s11897-014-0193-9.
Li D. L. , Hill J. A. Cardiomyocyte autophagy and cancer chemotherapy. J Mol Cell Cardiol. 2014 Jun;71: 54-61. doi: 10. 1016/j. yjmcc. 2013. 11. 007.
Wouters K. A. , Kremer L. C. , Miller T. L. , Herman E. H. et. al. Protecting against anthracycline-induced myocardial damage: a review of the most promising strategies. Br J Haematol. 2005 Dec;131 (5): 561-78. DOI: 10. 1111/j. 1365-2141. 2005. 05759. x
Vejpongsa P. , Yeh E. T. Prevention of anthracycline-induced cardiotoxicity: challenges and opportunities. J Am Coll Cardiol. 2014 Sep 2;64 (9): 938-45. doi: 10. 1016/j. jacc. 2014. 06. 1167.
Jahangir E. , Shah S. , Shum K. et. al. Risk assessment and management of anthracycline and HER2 receptor inhibitor-induced cardiomyopathy. South Med J. 2015 Feb;108 (2): 71-8. doi: 10. 14423/SMJ. 0000000000000232.
Zeglinski M. , Premecz S. , Lerner J. , Wtorek P. et. al. Congenital absence of nitric oxide synthase 3 potentiates cardiac dysfunction and reduces survival in doxorubicin- and trastuzumab-mediated cardiomyopathy. Can J Cardiol. 2014 Mar;30 (3): 359-67. doi: 10. 1016/j. cjca. 2013. 11. 013.
Leite de Oliveira R. , Deschoemaeker S. , Henze A. T. , Debackere K. et. al. Gene-targeting of Phd2 improves tumor response to chemotherapy and prevents side-toxicity. Cancer Cell. 2012 Aug 14;22 (2): 263-77. doi: 10. 1016/j. ccr. 2012. 06. 028.
Zhao W. J. , Wei S. N. , Zeng X. J. , Xia Y. L. et. al. Gene Expression Profiling Identifies the Novel Role of Immunoproteasome in Doxorubicin-Induced Cardiotoxicity. Toxicology. 2015 Apr 17. pii: S0300-483X (15) 00080-3. doi: 10. 1016/j. tox. 2015. 04. 009.
Krishnamurthy K. , Vedam K. , Kanagasabai R. , Druhan L. J. et. al. Heat shock factor-1 knockout induces multidrug resistance gene, MDR1b, and enhances P-glycoprotein (ABCB1) -based drug extrusion in the heart. Proc Natl Acad Sci U S A. 2012 Jun 5;109 (23): 9023-8. doi: 10. 1073/pnas. 1200731109.
Zhu J, et al. (2010) Recombinant human interleukin-1 receptor antagonist protects mice against acute doxorubicin-induced cardiotoxicity. Eur J Pharmacol. 643: 247-53. doi: 10. 1016/j. ejphar. 2010. 06. 024.
Schwartz D. R. , Briggs E. R. , Qatanani M. , Sawaya H. et. al. Human resistin in chemotherapy-induced heart failure in humanized male mice and in women treated for breast cancer. Endocrinology. 2013 Nov;154 (11): 4206-14. doi: 10. 1210/en. 2013-1399.
Perik P. J. , de Vries E. G. , Gietema J. A, van der Graaf W. T. et. al. Serum HER2 levels are increased in patients with chronic heart failure. Eur J Heart Fail. 2007 Feb; 9 (2): 173-7. DOI: 10. 1016/j. ejheart. 2006. 05. 010
Chien KR. Herceptin and the heart--a molecular modifier of cardiac failure. N Engl J Med. 2006 Feb 23; 354 (8): 789-90. DOI: 10. 1056/NEJMp058315
Adão R. , de Keulenaer G. , Leite-Moreira A. , Brás-Silva C. Cardiotoxicity associated with cancer therapy: pathophysiology and prevention strategies. Rev Port Cardiol. 2013 May;32 (5): 395-409. doi: 10. 1016/j. repc. 2012. 11. 002.
Chu TF, Rupnick MA, Kerkela R, et al. Cardiotoxicity associated with tyrosine kinase inhibitor sunitinib. Lancet. 2007;370: 2011-2019. DOI: http: //dx. doi. org/10. 1016/S0140-6736 (07) 61865-0
Dolci A. 1, Dominici R. , Cardinale D. , Sandri M. T. et. al. Biochemical markers for prediction of chemotherapy-induced cardiotoxicity: systematic review of the literature and recommendations for use. Am J Clin Pathol. 2008 Nov;130 (5): 688-95. doi: 10. 1309/AJCPB66LRIIVMQDR.
Perik P. J. 1, Rikhof B. , de Jong F. A. , Verweij J. et. al. Results of plasma N-terminal pro B-type natriuretic peptide and cardiac troponin monitoring in GIST patients do not support the existence of imatinib-induced cardiotoxicity. Ann Oncol. 2008 Feb;19 (2): 359-61. doi: 10. 1093/annonc/mdm468
Dolci A. , Dominici R. , Cardinale D. , Sandri M. T. et. al. Biochemical markers for prediction of chemotherapy-induced cardiotoxicity: systematic review of the literature and recommendations for use. Am J Clin Pathol. 2008 Nov;130 (5): 688-95. doi: 10. 1309/AJCPB66LRIIVMQDR.
Oreto L. , Todaro M. C. , Umland M. M. , Kramer C. et. al. Use of echocardiography to evaluate the cardiac effects of therapies used in cancer treatment: what do we know? J Am Soc Echocardiogr. 2012 Nov;25 (11): 1141-52. doi: 10. 1016/j. echo. 2012. 09. 001.
- < >
Di Lisi D. , Bonura F. , Macaione F. , Peritore A. Chemotherapy-induced cardiotoxicity: role of the tissue Doppler in the early diagnosis of left ventricular dysfunction. Anticancer Drugs. 2011 Jun;22 (5): 468-72. doi: 10. 1097/CAD. 0b013e3283443704.
Civelli M. , Cardinale D. , Martinoni A. , Lamantia G. et. al. Early reduction in left ventricular contractile reserve detected by dobutamine stress echo predicts high-dose chemotherapy-induced cardiac toxicity. Int J Cardiol. 2006 Jul 28;111 (1): 120-6. DOI: http: //dx. doi. org/10. 1016/j. ijcard. 2005. 07. 029
Sawaya, H. , Sebag, I. A. , Plana, J. C. , Januzzi, J. L. , Ky, B. , Cohen, V. et al. Early detection and prediction of cardiotoxicity in chemotherapy-treated patients. Am J Cardiol. 2011; 107: 1375–1380. doi: 10. 1016/j. amjcard. 2011. 01. 006
Dolci A. 1, Dominici R. , Cardinale D. , Sandri M. T. et. al. Biochemical markers for prediction of chemotherapy-induced cardiotoxicity: systematic review of the literature and recommendations for use. Am J Clin Pathol. 2008 Nov;130 (5): 688-95. doi: 10. 1309/AJCPB66LRIIVMQDR.
Cardinale, D. , Sandri, M. T. , Colombo, A. , et al. Prognostic value of troponin I in cardiac risk stratification of cancer patients undergoing high-dose chemotherapy. Circulation. 2004; 109: 2749–2754. doi: 10. 1161/01. CIR. 0000130926. 51766. CC
Cardinale, D. and Sandri, M. T. Role of biomarkers in chemotherapy-induced cardiotoxicity. Prog Cardiovasc Dis. 2010; 53: 121–129. doi: 10. 1016/j. pcad. 2010. 04. 002
Gertz M. A. Troponin in hematologic oncology. Leuk Lymphoma. 2008 Feb;49 (2): 194-203. Doi: 10. 1080/10428190701813026.
Cardinale D. , Sandri M. T. Role of biomarkers in chemotherapy-induced cardiotoxicity. Prog Cardiovasc Dis. 2010 Sep-Oct;53 (2): 121-9. doi: 10. 1016/j. pcad. 2010. 04. 002.
Sandri M. T. , Salvatici M. , Cardinale D. , Zorzino L. et. al. N-terminal pro-B-type natriuretic peptide after high-dose chemotherapy: a marker predictive of cardiac dysfunction? Clin Chem. 2005 Aug;51 (8): 1405-10. doi: 10. 1373/clinchem. 2005. 050153
Horacek J. M. , Jebavy L. , Vasatova M. , Pudil R. at. al. Glycogen phosphorylase BB as a potential marker of cardiac toxicity in patients treated with anthracyclines for acute leukemia. Bratisl Lek Listy. 2013;114 (12): 708-10.
Ky B. , Vejpongsa P. , Yeh E. T. , Force T. , et. al. Emerging paradigms in cardiomyopathies associated with cancer therapies. Circ Res. 2013 Aug 30;113 (6): 754-64. doi: 10. 1161/CIRCRESAHA. 113. 300218.
Takuma, S. , Ota, T. , Muro, T. et al. Assessment of left ventricular function by real-time 3-dimensional echocardiography compared with conventional noninvasive methods. J Am Soc Echocardiogr. 2001; 14: 275–284. DOI: http: //dx. doi. org/10. 1067/mje. 2001. 111158
Wassmuth, R. , Lentzsch, S. , Erdbruegger, U. , Schulz-Menger, J. , Doerken, B. , Dietz, R. et al. Subclinical cardiotoxic effects of anthracyclines as assessed by magnetic resonance imaging-a pilot DOI: http: //dx. doi. org/10. 1067/mhj. 2001. 115436
Panjrath G. S. , Jain D. J. Monitoring chemotherapy-induced cardiotoxicity: role of cardiac nuclear imaging. Nucl Cardiol. 2006 May-Jun;13 (3): 415-26. http: //dx. doi. org/10. 1016/j. nuclcard. 2006. 03. 002
Schwartz R. G. , Jain D. , Storozynsky E. Traditional and novel methods to assess and prevent chemotherapy-related cardiac dysfunction noninvasively. J Nucl Cardiol. 2013 Jun;20 (3): 443-64. doi: 10. 1007/s12350-013-9707-1.
Alexander C. , Oberhausen E. Myocardial scintigraphy. Semin Nucl Med. 1995 Apr;25 (2): 195-201. http: //dx. doi. org/10. 1016/S0001-2998 (95) 80026-3
de Geus-Oei LF, Mavinkurve-Groothuis AM, Bellersen L, Gotthardt M, Oyen WJ, Kapusta L, van Laarhoven HW. Scintigraphic techniques for early detection of cancer treatment-induced cardiotoxicity. J Nucl Med. 2011 Apr; 52 (4): 560-71. doi: 10. 2967/jnumed. 110. 082784
Saidi A. , Alharethi R. Management of chemotherapy induced cardiomyopathy. Curr Cardiol Rev. 2011 Nov;7 (4): 245-9. DOI: 10. 2174/157340311799960681
Ewer S. M. , Ewer M. S. Cardiotoxity profile of trastuzumab. Drug. Saf. 2008; 31 (6): 459-61. http: //dx. doi. org/10. 2165/00002018-200831060-00002
Gziri M. M. , Amant F. , Debiève F. , Van Calsteren K. et. al. Effects of chemotherapy during pregnancy on the maternal and fetal heart. Prenat Diagn. 2012 Jul;32 (7): 614-9. doi: 10. 1002/pd. 3847.
Zerra P. , Cochran T. R. , Franco V. I. , Lipshultz S. E. An expert opinion on pharmacologic approaches to reducing the cardiotoxicity of childhood acute lymphoblastic leukemia therapies. Expert Opin Pharmacother. 2013 Aug;14 (11): 1497-513. Doi: 10. 1517/14656566. 2013. 804911.
Iarussi D, Indolfi P, Casale F, et al. Anthracycline-induced cardiotoxicity in children with cancer: strategies for prevention and management. Paediatr Drugs. 2005;7: 67-76. http: //dx. doi. org/10. 2165/00148581-200507020-00001
Lipshultz SE, Giantris AL, Lipsitz SR, et al: Doxorubicin administration by continuous infusion is not cardioprotective: The Dana-Farber 91-01 acute lymphoblastic leukemia protocol. J Clin Oncol 20: 1677-1682, 2002. doi: 10. 1200/JCO. 20. 6. 1677
Singh D. , Thakur A. , Tang W. H. Utilizing Cardiac Biomarkers to Detect and Prevent Chemotherapy-Induced Cardiomyopathy. Curr Heart Fail Rep. 2015 Apr 15. doi: 10. 1007/s11897-015-0258-4.
Hensley M. L. , Hagerty K. L. , Kewalramani T. et. al. American Society of Clinical Oncology 2008 clinical practice guideline update: use of chemotherapy and radiation therapy protectants. Clin Oncol. 2009; 27 (1): 127 (1): 127-45. doi: 10. 1200/JCO. 2008. 17. 2627.
Phillips K. A. , Tannock I. F. Design and interpretation of clinical trials that evaluate agents that may offer protection from the toxic effects of cancer chemotherapy. J Clin Oncol. 1998 Sep;16 (9): 3179-90. http: //jco. ascopubs. org/content/16/9/3179. long
Lopez M. Dexrazoxane. Current status and prospectives of cardiotoxicity of chemotherapy. Clin Ter. 1999 Jan-Feb;150 (1): 37-49.
Cardinale D. , Colombo А. , Lamantia G. , et al. Anthracycline-induced cardiomyopathy. Clinical relevance and response to pharmacologic therapy. J Am Coll Cardiol, 55 (2010), pp. 213–220. doi: 10. 1016/j. jacc. 2009. 03. 095.
Silber J. H. , Cnaan A. , Clark B. J. , et al. Enalapril to prevent cardiac function decline in long-term survivors of pediatric cancer exposed to anthracyclines. J Clin Oncol, 22 (2004), pp. 820–828. doi: 10. 1200/JCO. 2004. 06. 022
Lipshultz S. E. , Colan S. D. Cardiovascular trials in long-term survivors of childhood cancer. J Clin Oncol 22: 769-773, 2004. doi: 10. 1200/JCO. 2004. 12. 937
D. Cardinale, A. Colombo, M. T. Sandri, et al. Prevention of high-risk chemotherapy-induced cardiotoxicity in high-risk patients by angiotensin-converting enzyme inhibition. Circulation, 114 (2006), pp. 2474–2481. doi: 10. 1161/CIRCULATIONAHA. 106. 635144
Santos D. L. , Moreno A. J. , Leino R. L. , et. al. Carvedilol protects against doxorubicin-induced mitochondrial cardiomyopathy. Toxicol Appl Pharmacol, 185 (2002), pp. 218–227. doi: 10. 1006/taap. 2002. 9532
Spallarossa P. , Garibaldi S. , Altieri P. , et al. Carvedilol prevents doxorubicin-induced free radical release and apoptosis in cardiomyocytes in vitro. J Mol Cell Cardiol, 37 (2004), pp. 837–846. DOI: http: //dx. doi. org/10. 1016/j. yjmcc. 2004. 05. 024
Kalay N. , Basar E. , Ozdogru I. et al. Protective effects of carvedilol against anthracycline-induced cardiomyopathy. J Am Coll Cardiol, 48 (2006), pp. 2258–2262. doi: 10. 1016/j. jacc. 2006. 07. 052
El-Shitany N. A. , Tolba O. A. , El-Shanshory M. R. Protective effect of carvedilol on adriamycin-induced left ventricular dysfunction in children with acute lymphoblastic leukemia. J Card Fail, 18 (2012), pp. 607–613. doi: 10. 1016/j. cardfail. 2012. 06. 416.
Kalay N. , Basar E. , Ozdogru I. , et al. Protective effects of carvedilol against anthracycline-induced cardiomyopathy. J Am Coll Cardiol, 48 (2006), pp. 2258–2262. doi: 10. 1016/j. jacc. 2006. 07. 052
Bosch X, Rovira M. , Sitges M. , Domènech A. et. al. Enalapril and carvedilol for preventing chemotherapy-induced left ventricular systolic dysfunction in patients with malignant hemopathies: the OVERCOME trial (preventiOn of left Ventricular dysfunction with Enalapril and caRvedilol in patients submitted to intensive ChemOtherapy for the treatment of Malignant hEmopathies). J Am Coll Cardiol. 2013 Jun 11;61 (23): 2355-62. doi: 10. 1016/j. jacc. 2013. 02. 072.
Georgakopoulos P. , Roussou P. , Matsakas E. , et al. Cardioprotectiveeffect of metoprolol and enalapril in doxorubicin-treated lymphoma patients: a prospective, parallel-group, randomized, controlled study with 36-month follow-up. American Journal of Hematology
2010 Nov; 85 (11): 894-6. doi: 10. 1002/ajh. 21840.
Nakamae H. , Tsumura K. , Terada Y. , et al. Notable effects of angiotensin II receptor blocker, valsartan, on acute cardiotoxic changes after standard chemotherapy with cyclophosphamide, doxorubicin, vincristine, and prednisolone. Cancer. 2005 Dec 1; 104 (11): 2492-8.
Cadeddu C. , Piras A. , Mantovani G. , et al. Protective effects of the angiotensin II receptor blocker telmisartan on epirubicin-induced inflammation, oxidative stress, and early ventricular impairment. American Heart Journal 2010 Sep; 160 (3): 487. e1-7. doi: 10. 1016/j. ahj. 2010. 05. 037.
Hofstatter E. , Saadati H. , Russell K. , Russell R. Clinical vignettes: integrated care of cancer patients by oncologists and cardiologists. Curr Cardiol Rev. 2011 Nov;7 (4): 258-61. DOI: 10. 2174/157340311799960654
Sayed-Ahmed M. M. Role of carnitine in cancer chemotherapy-induced multiple organ toxicity. Saudi Pharm J. 2010 Oct;18 (4): 195-206. doi: 10. 1016/j. jsps. 2010. 07. 008. Epub 2010 Aug 5.
Cao Y. , Ruan Y. , Shen T. et. al. Astragalus polysaccharide suppresses doxorubicin-induced cardiotoxicity by regulating the PI3k/Akt and p38MAPK pathways. Oxid Med Cell Longev. 2014;2014: 674219. doi: 10. 1155/2014/674219.
Zordoky B. N. , Robertson I. M. , Dyck J. R. Preclinical and clinical evidence for the role of resveratrol in the treatment of cardiovascular diseases. Biochim Biophys Acta. 2015 Jun;1852 (6): 1155-1177. doi: 10. 1016/j. bbadis. 2014. 10. 016.
Walker, J. R. , Sharma, A. , Lytwyn, M. , Bohonis, S. , Thliveris, J. , Singal, P. K. et al. The cardioprotective role of probucol against anthracycline and trastuzumab-mediated cardiotoxicity. J Am Soc Echocardiogr. 2011; 24: 699–705. doi: 10. 1016/j. echo. 2011. 01. 018
Тdoi: 10. 1016/j. taap. 2010. 12. 012.
Hamed, S. , Barshack, I. , Luboshits, G. , Wexler, D. , Deutsch, V. , Keren, G. et al. Erythropoietin improves myocardial performance in doxorubicin-induced cardiomyopathy. Eur Heart J. 2006; 27: 1876–1883]
Agarwal, M. , Phan, A. , Willix, R. Jr. , Barber, M. , and Schwarz, E. R. Is vitamin D deficiency associated with heart failure? A review of current evidence. J Cardiovasc Pharmacol Ther. 2011; 16: 354–363. doi: 10. 1177/1074248410390214.
Daosukho C, Chen Y, Noel T, et al. Phenylbutyrate, a histone deacetylase inhibitor, protects against Adriamycin-induced cardiac injury. Free Radic Biol Med. 2007;42: 1818-1825. doi: 10. 1016/j. freeradbiomed. 2007. 03. 007
Ikegami E, Fukazawa R, Kanbe M, et al. Edaravone, a potent free radical scavenger, prevents anthracycline-induced myocardial cell death. Circ J. 2007;71: 1815-1820. http: //doi. org/10. 1253/circj. 71. 1815
Bruynzeel AM, Niessens HW, Bronzwaer JG, et al. The effect of monohydroxyethylrutoside on doxorubicin-induced cardiotoxicity in patients treated for metastatic cancer in a phase II study. Br J Cancer. 2007;97: 1084-1089. doi: 10. 1038/sj. bjc. 6603994
Savarese D. M. , Savy G. , Vahdat L. , Wischmeyer P. E. et. al. Prevention of chemotherapy and radiation toxicity with glutamine. Cancer Treat Rev. 2003 Dec;29 (6): 501-13. http: //dx. doi. org/10. 1016/S0305-7372 (03) 00133-6
Alimoradi H. , Barzegar-Fallah A. , Hassanzadeh G. , Mohammadi-Rick S. et. al. The cardioprotective effects of an antiemetic drug, tropisetron, on cardiomyopathy related to doxorubicin. Cardiovasc Toxicol. 2012 Dec;12 (4): 318-25. doi: 10. 1007/s12012-012-9175-x. ;
Ammon M. , Arenja N. , Leibundgut G. , Buechel R. R. et. al. Cardiovascular management of cancer patients with chemotherapy-associated left ventricular systolic dysfunction in real-world clinical practice. J Card Fail. 2013 Sep;19 (9): 629-34. doi: 10. 1016/j. cardfail. 2013. 07. 007.
Schweiger M. , Dave H. , Lemme F. , Cavigelli-Brunner A. et. al. Acute chemotherapy-induced cardiomyopathy treated with intracorporeal left ventricular assist device in an 8-year-old child. ASAIO J. 2013 Sep-Oct;59 (5): 520-2. doi: 10. 1097/MAT. 0b013e3182a0d242.
Oliveira G. H. , Dupont M. , Naftel D. , Myers S. L. et. al. Increased need for right ventricular support in patients with chemotherapy-induced cardiomyopathy undergoing mechanical circulatory support: outcomes from the INTERMACS Registry (Interagency Registry for Mechanically Assisted Circulatory Support). J Am Coll Cardiol. 2014 Jan 28;63 (3): 240-8. doi: 10. 1016/j. jacc. 2013. 09. 040.
Oliveira G. H. , Hardaway B. W. , Kucheryavaya A. Y. et. al. Characteristics and survival of patients with chemotherapy-induced cardiomyopathy undergoing heart transplantation. J Heart Lung Transplant. 2012 Aug;31 (8): 805-10. doi: 10. 1016/j. healun. 2012. 03. 018. Epub 2012 May 1.
13 июля 2015 г.
Ещё больше полезной информации на нашем Телеграм-канале