Введение. В последние годы в мире происходит значительный рост количества рентгенохирургических вмешательств, большую часть из которых составляют операции на сердце и сосудах. Для адекватной визуализации состояния сосудистого русла и проведения эндоваскулярных операций необходимо выполнение ангиографических исследований с введением контрастных веществ (КВ). В современных условиях рентгенохирургические вмешательства часто выполняются у пожилых пациентов с различными сопутствующими заболеваниями (сахарный диабет, артериальная гипертензия, сердечная недостаточность, заболевания почек и др. ). Эндоваскулярные операции становятся более сложными, часто многоэтапными и выполняются с применением значительного объема КВ. Все вышеизложенное свидетельствует о необходимости более широкого освещения вопросов по использованию КВ в интервенционной кардиологии и ангиологии; особенного внимания заслуживают различные осложнения и способы их профилактики (1, 2, 3).
История использования контрастных веществ в интервенционной ангиологии.
В 1895 году В. К. Рентген открыл неизвестные ранее лучи, названные им “X-лучами”. Интересно, что уже в 1896 году В. М. Бехтерев предсказал открытие ангиографии. Выдающийся русский невролог заметил: “Раз стало известно, что некоторые растворы не пропускают лучи Рентгена, то сосуды мозга могут быть заполнены ими и сфотографированы “in situ”.
Реальное использование рентгеноконтрастных веществ началось гораздо позже. В 1923 году Berberich и Hirsch сделали первую в истории прижизненную ангиограмму артерий и вен руки с помощью бромида стронция. В 1924 году Brooks, используя йодистый натрий, впервые выполнил ангиограмму артерий нижней конечности, а в 1929 г. Renaldo dos Santos и коллеги провели первую прижизненную брюшную аортографию с помощью йодистого натрия. Вышеперечисленные исследования выполнялись с помощью солей тяжелых металлов и неорганических солей йода. Крайне высокая токсичность этих веществ ограничивала дальнейшее развитие ангиографии, ввиду большого числа осложнений.
Присоединение атомов йода к молекулам органических веществ позволило создать новые, менее токсичные рентгеноконтрастные вещества. В 1925 – 1929 гг. компанией Эрнеста Шеринга велась активная разработка органических йодсодержащих КВ; уже в 1929 году Swick впервые выполнил в/в урографию с помощью йодсодержащего препарата уроселектан (Schering AG). В 1950-х годах в клиническую практику были внедрены йодсодержащие КВ из группы диатризоатов (урографин, ренографин, гипак), которые были менее токсичны, чем прежние препараты. Следующей значимой вехой в интервенционной кардиологии стало выполнение первой селективной коронарографии F. Sones в 1958 году (с помощью гипака).
В 1964 году шведский радиолог Torsten Аlmen разработал новую концепцию строения КВ, и в 1969 году по его заказу было синтезировано первое неионное контрастное вещество Амипак. Необходимо отметить, что после внедрения неионных КВ частота осложнений после выполнения ангиографии значительно уменьшилась. Как известно, первую баллонную ангиопластику коронарных артерий у человека выполнил в 1977 году А. Gruentzig, а первое стентирование коронарных артерий – в 1986 году U. Sigwart (Швейцария) и J. Puel (Франция), в разных клиниках, независимо друг от друга. Пионеры интервенционной кардиологии выполняли свои первые вмешательства уже с помощью более безопасных неионных КВ.
В настоящее время в интервенционной кардиологии и ангиологии используют только неионные низкоосмолярные (омнипак, ксенетикс) и изоосмолярные (визипак) контрастные препараты (1, 2). Основные виды контрастных веществ (КВ) представлены в таблице 1.
Свойства контрастных веществ.
Выделяют несколько основных факторов, которые определяют безопасность контрастного препарата. Это осмолярность, вязкость, гидрофильность, растворимость и электрическая активность (ионность).
Виды контрастных веществ | Международное название | Торговое название | |
Ионные | Мономеры (высокоосмолярные) | Амидотриозат | Урографин |
Метриозат | Изопак | ||
Йокситаламат | Телебрикс | ||
Димеры (низкоосмолярные) | Йоксаглат | Гексабрикс | |
Неионные | Мономеры (низкоосмолярные) | Йопромид | Ультравист |
Йогексол | Омнипак | ||
Йоверсол | Оптирей | ||
Йобитридол | Ксенетикс | ||
Димеры (изоосмолярные) | Йодиксанол | Визипак | |
Таблица 1. Виды контрастных веществ, используемых в интервенционной ангиологии.
Осмолярность определяется числом частиц вещества в растворе. Чем больше данных частиц, тем выше осмолярность. Относительно крови человека, осмолярность которой составляет 280 мОсм/кг Н2О, контрастные препараты могут быть низкоосмолярными, если осмолярность не превышает 1200 мОсм/кг Н2О, высокоосмолярными - выше 1200 мОсм/кг Н2О и изоосмолярными. Высокая осмолярность раствора является неблагоприятным фактором, поскольку при введении высокогипертоничных растворов в кровь наблюдается расширение сосудов и наступает “сладж-эффект”, вызванный повышением осмотического давления крови. При этом оказывается отрицательное воздействие на эндотелий, кровяные клетки, клеточные мембраны и протеины.
Вязкость – свойство жидкостей, характеризующее сопротивление действию внешних сил, вызывающих их течение. С одной стороны, более высокая вязкость контрастного вещества является положительным фактором, поскольку определяет лучшую контрастность изображения, с другой – отрицательной, т. к. может ухудшать микроциркуляцию в почках. Высокая гидрофильность и низкая липофильность молекулы также являются важными свойствами, поскольку они уменьшают вероятность взаимодействия контрастного вещества с клеткой и, главное, уменьшают вероятность осложнений. Большое влияние на безопасность того или иного КВ оказывает его ионность. В водной среде ионные контрастные вещества распадаются на ионы, в результате количество частичек вещества увеличивается в два раза (из одной молекулы твердого вещества образуется два связанных с водой иона). В отличие от этого, неионные растворы в водной среде не диссоциируют. Поэтому все ионные растворы в силу двукратного увеличения содержания в них отдельных частиц (ионов) имеют осмолярность вдвое большую, чем неионные растворы, что делает их более опасными препаратами для применения.
В современных условиях пока не удалось синтезировать молекулу контрастного вещества, которая бы сочетала в себе только положительные качества, т. е. содержала бы большое количество атомов йода (для высокого качества изображения), обладала высокой гидрофильностью и растворимостью, небольшой вязкостью и низкой осмолярностью. Это происходит вследствие того, что усиление одних полезных качеств всегда ведет к ослаблению других. Поэтому на сегодняшний день в интервенционной ангиологии применяют контрастные препараты с оптимальным соотношением между полезными и нежелательными их свойствами. Так, по данным некоторых исследований, у пациентов с исходно высоким риском развития нефропатии изоосмолярный димер Визипак является более безопасным препаратом, чем низкоосмолярные мономеры Омнипак и Ультравист (4, 5). Тем не менее, изоосмолярные КВ являются более вязкими, чем низкоосмолярные, что, в свою очередь, может являться одним из факторов риска развития нефропатии.
Осложнения при введении контрастных веществ.
Выделяют рефлекторные реакции на введение КВ в сосудистое русло, которые лишь условно можно причислить к осложнениям. Так, при инъекции контрастных препаратов в коронарные артерии может наблюдаться падение артериального давления и частоты сердечных сокращений. При введении КВ в полость сердца иногда отмечается снижение артериального давления, повышение частоты сердечных сокращений и возникновение различных аритмий. Данные реакции обычно непродолжительны и редко приводят к ухудшению состояния пациента.
К наиболее значимым осложнениям относятся тошнота, рвота, кожный зуд, крапивница, анафилактический шок и отек легких. Следует отметить, что в современных условиях данные проблемы встречаются редко; это связано с появлением неионных низко- и изоосмолярных КВ. Тем не менее, до сих пор сохраняется проблема контраст-индуцированной нефропатии (1, 2, 4, 5).
Контраст-индуцированная нефропатия (КИН) - это нарушение почечной функции после внутрисосудистого введения контрастных веществ, обычно определяемое как увеличение концентрации сывороточного креатинина более чем на 25%, или ≥ 0, 5 мг/дл (44 мкмоль/л). В интервенционной кардиологии и ангиологии данное осложнение является одним из наиболее серьезных. Общеизвестно, что КИН является третьей по частоте причиной развития острой почечной недостаточности в стационаре и развивается примерно у 1-5% пациентов, подвергаемых эндоваскулярным вмешательствам. В группах высокого риска частота развития КИН после проведения рентгенохирургических операций достигает 50%, а необходимость использования гемодиализа – 15%.
Главным патогенетическим механизмом, вызывающим развитие КИН, считается вазоконстрикция, приводящая к снижению почечного кровотока и скорости клубочковой фильтрации (СКФ). Также играют роль такие факторы, как стимуляция ренин-ангиотензиновой системы (РАС) и повышение гидростатического давления в канальцах, вызывающее ухудшение интраренальной микроциркуляции. Длительная вазоконстрикция афферентных артериол со снижением фильтрационного давления в клубочках неизбежно сопровождается последующей ишемией мозгового вещества. Как показали эксперименты на животных, введение КВ сопровождалось увеличением продукции свободных кислородных радикалов, снижением активности антиоксидантных ферментов и прямыми токсическими эффектами медиаторов свободных радикалов кислорода.
Наиболее важными факторами риска развития КИН, связанными с пациентом, являются: исходная почечная недостаточность, сахарный диабет, возраст, гиповолемия, гипотензия, низкий сердечный выброс, сердечная недостаточность, пересадка почки в анамнезе, гипоальбуминемия (< 35 г/л) и прием нефротоксичных лекарств. Из факторов, связанных с вмешательством, особенно нужно выделить высокую осмолярность контрастного вещества, большой объем введенного КВ, интраартериальное введение КВ и повторные рентгенохирургические операции в течение 72 часов.
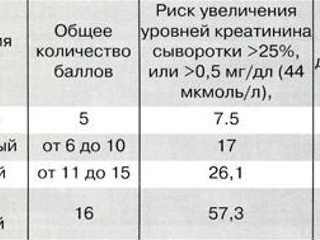
В 2004 году известный американский ученый R. Mehran предложила схему стратификации риска развития КИН, которая в настоящее время является наиболее используемой в мире (6). Согласно этой схеме, каждому фактору риска у данного пациента соответствует определенное число баллов которые потом суммируются.
В зависимости от суммы полученных баллов больному присваивается та или иная степень риска развития КИН (от низкого до очень высокого) и рассчитывается количественный риск выполнения диализа после проведения интервенционного вмешательства (см. таблицу 2).
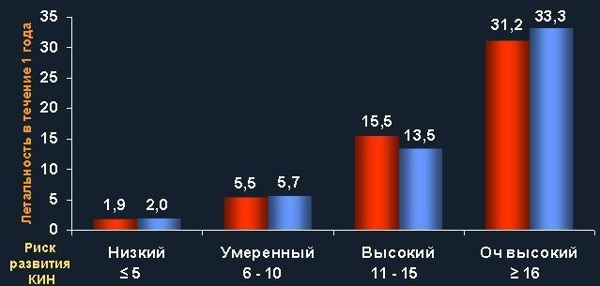
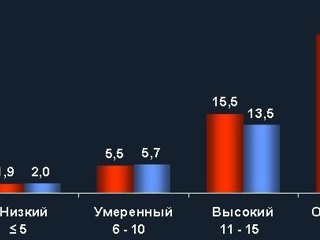
При анализе отдаленных результатов эндоваскулярных операций у пациентов с разными степенями риска развития КИН были получены интересные результаты. Оказалось, что у пациентов с исходно очень высокой степенью риска по Mehran летальность в течение года после вмешательства составила более 30% (см. рис. 1).
Меры профилактики КИН.
Для снижения риска развития КИН было исследовано множество препаратов – антагонисты аденозина, статины, аскорбиновая кислота, простагландин Е1, допамин, теофиллин, блокаторы кальциевых каналов, L-аргинин, фуросемид, маннитол и другие (7, 8). Особенные надежды возлагались на N-ацетилцистеин, прием которого перед введением контрастных веществ, по данным ряда исследований, снижал вероятность развития КИН и даже был рекомендован для использования у пациентов высокого риска в ряде международных руководств. Однако, данные последних рандомизированных исследований, выполненных на большом количестве больных, свидетельствуют о неубедительном эффекте данного препарата. Так, в рекомендациях 2011 года по лечению пациентов с нестабильной стенокардией Американского Кардиологического Общества ацетилцистеин вообще был вычеркнут из списка мероприятий, рекомендуемых для профилактики КИН (9). По остальным препаратам достоверно положительных результатов также не было получено. Не снижало риск развития КИН в группах пациентов высокого риска использование превентивного гемодиализа или гемофильтрации после выполнения эндоваскулярных вмешательств. В большинстве исследований достоверно подверждается, что единственным реальным методом борьбы с КИН остается гидратация пациента.
Важным элементом профилактики КИН является уменьшение объема вводимого контрастного препарата. Особенное значение это имеет для пациентов с исходно повышенным уровнем креатинина и другими признаками нарушения функции почек (10).
Рекомендуемое максимальное количество КВ для введения при нормальной почечной функции рассчитывается по формуле:
Макс. объем КВ в мл = вес (в кг) х 5
при почечной дисфункции:
Макс. объем КВ в мл = клиренс креатинина (мл/мин) х 5
Использование КВ у пациентов с электролитными нарушениями, в состоянии шока или застойной сердечной недостаточности допускается только по жизненным показаниям (например, при остром инфаркте миокарда). Не следует выполнять рентгенохирургические операции у плановых пациентов до тех пор, пока не будет скорректирован гемодинамический статус и уровень электролитов в сыворотке крови. Кроме того, как минимум за 2 дня перед эндоваскулярным вмешательством должны быть отменены потенциально нефротоксичные препараты, нестероидные противовоспалительные средства, антибиотики и метформин у пациентов с сахарным диабетом. В нашей стране наиболее часто используют схему профилактики КИН, предложенную Российским научным обществом интервенционных кардиоангиологов (РНОИК), которая представлена ниже.
Рекомендации по профилактике КИН Российского научного общества интервенционных кардиоангиологов:
- В/в гидратация 0, 9% раствором NaCl за 2 часа до и спустя 24 часа после введения КВ со скоростью 0, 5 мл/кг/час, при сердечной недостаточности – 1 мл/кг/час; дополнительно рекомендовано обильное питье до и после введения контрастного вещества;
- Стимуляция диуреза лазиксом в/в 0, 5 мг/кг при отрицательном балансе диуреза;
- Контроль диуреза и уровня креатинина в течение 3 суток после введения КВ;
- Отмена метформина, нестероидных противовоспалительных средств и цитотоксических антибиотиков за 48 часов до вмешательства;
- У больных со сниженной функцией почек рекомендовано использование низко- или изоосмолярных КВ (кроме йоксаглата и йогексола) ;
- Использование катетеров малого калибра и автоматических инжекторов;
- Ограничение объема вводимого КВ.
В заключение следует сказать, что использование современных рентгеноконтрастных веществ является относительно безопасным при выполнении эндоваскулярных вмешательств в общей популяции пациентов с сердечно-сосудистыми заболеваниями. Тем не менее, у определенных групп больных необходимо выполнение профилактических мер для предотвращения осложнений (прежде всего, контраст-индуцированной нефропатии).
Список литературы.
1. Gleeson T. , Bulugahapitiya S. Contrast-Induced Nephropathy // Am J Roentgenol 2004; 183 (6): 1673-1689.
2. Thomsen H. S. , Morcos S. K. Contrast media and the kidney: European Society of Urogenital Radiology (ESUR) Guidelines // British Journal of Radiology 2003; 76: 513-518.
3. Goldenberg I. , Matetzky S. Nephropathy induced by contrast media: pathogenesis, risk factors and preventive strategies // CMAJ 2005; 24: 172 (11).
4. Morcos S. K. Prevention of contrast media nephrotoxicity – the story so far // Clin Radiol 2004; 59: 381-389.
5. Safirstein R. , Andrade L. , Vieira J. M. Acetylcysteine and nephrotoxic effects of radiographic contrast agents: a new use for an old drug // N Engl J Med 2000; 343: 210-212.
6. Mehran R. , Aymong E. D. , Nikolsky E. et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: development and initial validation // J Am Coll Cardiol. 2004; 44: 1393-1399.
7. Vaitkus P. T. Current status of prevention, diagnosis, and management of coronary artery disease in patients with kidney failure // Am Heart J 2000; 139: 1000-1008.
8. Barrett B. J. , Parfrey P. S. Preventing nephropathy induced by contrast medium // N. Engl. J. Med. 2006;354 (4): 379-386.
9. 2011 ACCF/AHA Focused Update of the Guidelines for the Management of Patients With Unstable Angina/ Non–ST-Elevation Myocardial Infarction // Circulation. 2011; 123: 2039-2040.
10. Aspelin P. , Aubry P. , Fransson S. G. ct al. Nephrotoxic effects in high-risk patients undergoing angiography // N. Engl. J. Med. 2003; 348 (6): 491-499.
28 октября 2015 г.
Ещё больше полезной информации на нашем Телеграм-канале