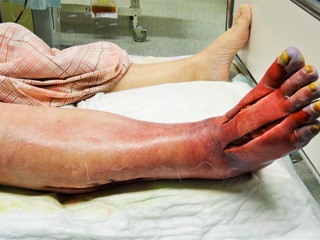
Синдром длительного сдавления (СДС) – это тяжёлое патологическое состояние, возникающее в результате закрытого повреждения больших участков мягких тканей под влиянием большой и/или длительно действующей механической силы, сопровождающийся комплексом специфических патологических расстройств (шок, нарушения сердечного ритма, острого повреждения почек, компартмент-синдром), чаще всего в конечностях на срок более 2 часов.
Впервые СДС был описан Пироговым Н. И. в 1865 году в «Началах общей военно-полевой хирургии» как «местная асфиксия» и «токсическое напряжение тканей». Особое внимание привлек к себе СДС во время Второй мировой войны. В 1941 году английские учёные Bywaters Е. и Beall D. , принимая участие в лечении жертв бомбардировок Лондона немецкой авиацией, выделили этот синдром в отдельную нозологическую единицу. У жителей Лондона, пострадавших от фашистских бомбардировок, СДС регистрировался в 3, 5-5% случаев и сопровождался высокой летальностью. В 1944 году Bywaters Е. и Beall D. определили, что миоглобин играет ведущую роль в развитии почечной недостаточности.
В отечественной литературе СДС впервые под названием «синдром размозжения и травматического сжатия конечностей» описал в 1945 году Пытель А. Я. На основании материалов Ашхабадского землетрясения 1948 года Еланским Н. Н. в 1950 году была подробно описана клиническая картина и лечение синдрома длительного раздавливания, и высказано мнение о ведущей роли токсикоза в развитии клинической картины.
В мирное время наиболее часто СДС возникает у пострадавших во время землетрясений и техногенных катастроф (табл. 1).
Таблица 1
Частота развития СДС при землетрясениях
Место землетрясения, год, автор | Число пострадавших | Частота СДС, % |
Ашхабад, 1948 г. (Кузин М. И. ) | 114 | 3, 8 |
Марокко, 1960 г. (Шутеу Ю. и соавт. ) | 118 | 7, 6 |
Италия, 1980 г. (Santangeio М. et al. ) | 19 | 21, 8 |
Армения, 1988 г. (Нечаев Э. А. ) | 765 | 23, 8 |
Чаще всего (79, 9% случаев) СДС встречается при закрытой травме мягких тканей нижних конечностей, в 14% - при повреждении верхних и в 6, 1% - при одновременном повреждении верхних и нижних конечностей.
В таблице 2 приведены основные причины, приводящие к СДС.
Таблица 2
Основные этиологические факторы СДС
Варианты | Этиологические факторы |
Травматический | Электротравма, ожоги, отморожения, тяжёлая сочетанная травма |
Ишемический | Синдром позиционного сдавления, «турникетный синдром», тромбоз, артериальная эмболия |
Гипоксический (перенапряжение и выраженная гипоксия мышечной ткани) | Избыточные физические нагрузки, «маршевая миоглобинурия», столбняк, судороги, озноб, эпилептический статус, белая горячка |
Инфекционный | Пиомиозит, сепсис, бактериальные и вирусные миозиты |
Дисметаболический | Гипокалиемия, гипофосфатемия, гипокальциемия, гиперосмолярность, гипотиреоз, сахарный диабет |
Токсический | Укусы змей и насекомых, лекарственная токсичность (амфетамин, барбитураты, кодеин, колхицин, комбинация «ловастатин–итраконазол», комбинация циклоспорин–симвастатин), героин, N, N-диэтиламид лизергиновой кислоты, метадон |
Генетически обусловленный | Болезнь МакАрдла (нехватка фосфорилазы в мышечной ткани), болезнь Таруи (отсутствие фосфофруктокмазы) |
В результате сдавления тканей происходит нарушение кровотока в сосудах и накопление продуктов жизнедеятельности тканей. После восстановления кровотока продукты клеточного распада (миоглобин, гистомин, серотонин, олиго– и полипептиды, калий) начинают поступать в системный кровоток. Патологические продукты активируют свёртывающую систему крови, что приводит к развитию ДВС-синдрома. Необходимо отметить, что ещё одним повреждающим фактором является депонирование воды в повреждённых тканях и развитие гиповолемического шока. Высокая концентрация миоглобина в почечных канальцах в условиях кислой среды приводит к формированию нерастворимых глобул, вызывающих внутриканальцевую обструкцию и острый канальцевый некроз.
В результате гиповолемии, ДВС-синдрома, поступающих в кровоток продуктов цитолиза, в частности миоглобина, развивается полиорганная недостаточность, ведущее место в которой занимает острое повреждение почек (ОПП).
В зависимости от обширности и длительности сдавления тканей выделяют три степени тяжести течения СДС (табл. 3).
Таблица 3
Классификация СДС по степени тяжести
Тяжесть течения | Область сдавления конечности | Ориентировочные сроки сдавления | Выраженность эндотоксикоза | Прогноз |
СДС лёгкой степени | Небольшая (предплечье или голень) | Не более 2-3 часов | Эндогенная интоксикация незначительная, олигурия устраняется через несколько суток | Благоприятный |
СДС средней тяжести | Более обширные участки сдавления (бедро, плечо) | От 2-3-х до 6 часов | Умеренный эндотоксикоз и ОПП в течение недели и более после травмы | Определяется сроками и качеством первой помощи и лечения с ранним применением экстракорпоральной детоксикации |
СДС тяжелой степени | Сдавление одной или двух конечностей | Более 6 часов | Быстро нарастает тяжёлая эндогенная интоксикация, развивается полиорганная недостаточность, включая ОПП | При отсутствии своевременного интенсивного лечения с использованием гемодиализа прогноз неблагоприятен |
Клиническая картина СДС имеет чёткую периодичность.
Первый период (от 24 до 48 часов после освобождения от сдавления) характеризуется развитием отёка тканей, гиповолемическим шоком и болевым синдромом.
Второй период СДС (с 3-4-х по 8-12-е сутки) проявляется нарастанием отёка сдавленных тканей, нарушением микроциркуляции и формированием ОПП. В лабораторных анализах крови обнаруживается прогрессирующая анемия, гемоконцентрация сменяется гемодилюцией, уменьшается диурез, растет уровень остаточного азота. Если лечение оказывается неэффективным, развиваются анурия и уремическая кома. Летальность в этот период достигает 35%.
В третьем периоде (с 3-4 недели заболевания) наблюдаются клинические проявления полиорганной недостаточности, включающие ОПП, острое повреждение лёгких, сердечную недостаточность, ДВС-синдром и желудочно-кишечное кровотечение. В данный период возможно присоединение гнойной инфекции, что может привести к развитию сепсиса и летальному исходу.
Завершается СДС периодом реконвалесценции и восстановлением утраченных функций. Данный период начинается с непродолжительной полиурии, что свидетельствует о разрешении ОПП. Постепенно восстанавливается гомеостаз.
Диагностика СДС основывается на анамнестических и клинико-лабораторных данных.
Лабораторные признаки СДС складываются из повышения уровня креатинфосфокиназы, метаболического ацидоза, гиперфосфатемии, мочевой кислоты и миоглобина. Доказательством тяжёлого повреждения почек является кислая реакция мочи, появление крови в моче (макрогематурия). Моча становится красной, её относительная плотность значительно увеличивается, определяется белок в моче. Признаками ОПП служат снижение диуреза до олигурии (суточный диурез менее 400 мл), повышение уровня мочевины, креатинина, калия сыворотки крови.
Лечебные мероприятия должны начинаться на догоспитальном этапе и включают в себя обезболивание, внутривенную инфузию жидкости, введение гепарина. Пострадавший должен быть доставлен в стационар в кратчайшие сроки. При наблюдении и лечении больных необходимо учитывать риск развития гиперкалиемии вскоре после высвобождение пострадавшей конечности, проводить тщательный мониторинг в отношении развития шока и метаболических расстройств.
В стационаре по показаниям проводится хирургическая обработка поражённых участков, включая «лампасные» разрезы с обязательным рассечением кожи, подкожной клетчатки и фасций в пределах отёчных тканей. Это необходимо для снятия вторичной компрессии поражённых тканей. В случае выявления некроза только части мышц конечности выполняется их иссечение – миэктомия. Нежизнеспособные конечности с признаками сухой или влажной гангрены, а также ишемического некроза (мышечная контрактура, полное отсутствие чувствительности, при диагностическом рассечении кожи – мышцы тёмные или наоборот обесцвеченные, желтоватые, при надрезе не сокращаются и не кровоточат) подлежат ампутации выше уровня границы сдавления, в пределах здоровых тканей.
Обязательными является проведения массивной инфузионной терапии. Инфузионная терапия направлена на коррекцию водно-электролитных нарушений, шока, метаболического ацидоза, профилактику ДВС-синдрома и уменьшения или предотвращения ОПП.
Антибактериальная терапия должна начинаться, как можно раньше и использована не только для лечения, но, прежде всего, для профилактики инфекционных осложнений. При этом необходимо исключить применение нефро- и гепатотоксичных препаратов.
Более 10% пострадавших нуждаются в проведении экстракорпоральной детоксикации. Анурия в течение суток при неэффективности консервативной терапии, гиперазотемия (мочевина более 25 ммоль/л, креатинин более 500 мкмоль/л), гиперкалиемия (более 6, 5 ммоль/л), сохраняющиеся гипергидратация и метаболический ацидоз требуют незамедлительного начала заместительной почечной терапии – гемодиализа, гемофильтрации, гемодиафильтрации. Методы заместительной почечной терапии позволяют удалять из кровотока средне- и низкомолекулярные токсические вещества, устранять нарушения кислотно-основного состояния и водно-электролитные нарушения.
В первые сутки показано проведение плазмафереза (ПФ). Согласно данным, представленным Воробьёвым П. А. (2004), ПФ показал высокую эффективность при лечении больных пострадавших в результате землетрясения в Армении в 1988 г. Проведение ПФ в первые сутки после декомпрессии позволило снизить частоту возникновения ОПП до 14, 2%. Эффективность ПФ связана с быстрым удалением миоглобина, тканевого тромбопластина и других продуктов клеточного распада.
СДС в настоящее время имеет тенденцию к росту во всём мире. Это связано, в том числе с увеличением пострадавших в результате дорожно-транспортных происшествий. Прогнозировать течение заболевания достаточно сложно, так как большинство данных поступают из очагов землетрясений и других техногенных катастроф. Согласно имеющимся данным летальность зависит от сроков начала лечения и составляет от 3 до 50%. В случае развития ОПП летальность может достигать 90%. Применение методов заместительной почечной терапии позволило снизить летальность до 60%.
Литература
- Воробьев П. А. Актуальный гемостаз. – М.: Издательство «Ньюдиамед», 2004. – 140 с.
- Гуманенко Е. К. Военно-полевая хирургия локальных войн и военных конфликтов. Руководство для врачей / под ред. Гуманенко Е. К. , Самохвалова И. М. – М. , ГЭОТАР-Медиа, 2011. – 672 с.
- Genthon A. , Wilcox S. R. Crush syndrome: a case report and review of the literature. // J. Emerg. Med. – 2014. – Vol. 46. – №2. – P. 313 – 319.
- Malinoski D. J. , Slater M. S. , Mullins R. J. Crush injury and rhabdomyolysis. // Crit. Care. – 2004. – Vol. 20 – P. 171 – 192.
- Sever MS. Rhabdomyolysis. // Acta. Clin. Belg. Suppl. – 2007. – Vol. 2. – P. 375 – 379.
5 ноября 2015 г.
Ещё больше полезной информации на нашем Телеграм-канале