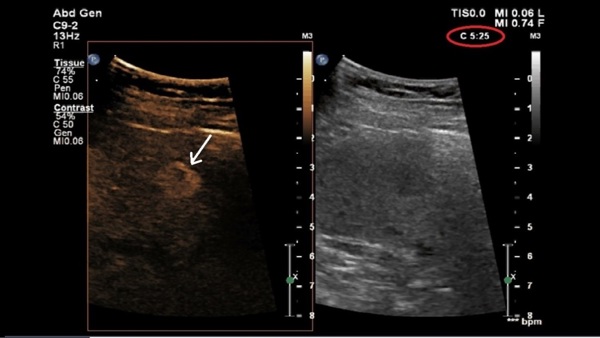
Лучевая диагностика играет важную роль в первичной диагностике различных онкологических заболеваний. Постоянное развитие и совершенствование ультразвукового метода заставляет нас уделять все больше внимания появляющимся новым технологиям, чтобы своевременно внедрять их в клиническую практику. Несомненно, использование эхоконтрастирования открывает новые горизонты в ультразвуковой диагностике, позволяя повысить его эффективность и информативность, предоставляя во многом уникальную диагностическую информацию.
Зубарев А.В., Фёдорова А.А., Чернышев В.В., Варламов Г.В., Соколова Н.А., Федорова Н.А. Введение. Современная лучевая диагностика неразрывно связана с использованием контрастных препаратов — йодсодержащих в рутинной рентгенодиагностике и компьютерной томографии и препаратов, изменяющих магнитные свойства тканей, — парамагнетиков — в магнитно-резонансной томографии. До недавнего времени ультразвуковой метод исследования был единственным, в котором не рассматривалось применение контрастных препаратов. С внедрением методик ультразвуковой цветовой ангиографии появилась возможность получения принципиально новой диагностической информации. Ультразвуковая ангиография – собирательное понятие, куда входит несколько способов получения УЗ-изображений сосудов: цветовое допплеровское картирование, энергетическое картирование, методики гармонического изображения, искусственное контрастирование с помощью внутривенно вводимых контрастных веществ, трехмерная реконструкция сосудов. С помощью УЗ-ангиографии можно неинвазивно визуализировать различные сосудистые структуры и получить ранее не доступную для стандартного ультразвукового исследования в В-режиме, информацию. Так, ультразвуковая цветовая допплерография до недавнего времени считалась уникальной неинвазивной методикой исследования сосудов. Общеизвестно, что в очень мелких сосудах уловить различия в допплеровском сдвиге частот от медленно движущейся крови и движений стенки сосуда и окружающих тканей практически невозможно. Невозможность визуализации мелких и глубокорасположенных сосудов при обычных режимах сканирования стала основным недостатком этого метода. Устранить эту основную помеху помогли эхоконтрастные вещества, обеспечивающие усиление отраженного ультразвукового сигнала от элементов крови. Различными исследованиями было показано, что эхоконтрастные вещества улучшают свойства допплеровских сигналов. Таким образом, стало возможным изучать сосудистый рисунок, оценивать его характер, прослеживать фазы накопления и выведения контрастных препаратов, изучать гемодинамику. Чувствительность ЦДК, ЭК и методик нативного контрастирования в отображении сосудов может быть значительно повышена при использовании внутривенно вводимых контрастных препаратов. Помимо этого, использование контрастных препаратов позволило решить проблему визуализации мелких глубокорасположенных сосудов со слабым кровотоком. Сегодня эхоконтрастные препараты активно внедряются в клиническую практику и обеспечивают возможность проведения контрастного усиления, по аналогии с методиками контрастного усиления при КТ и МРТ. Более того, информация, получаемая при эхоконтрастировании, сопоставима с информацией, получаемой при КТ- и МР-ангиографии, классической рентгеновской ангиографии, и в большинстве случаев ее бывает достаточно для установления правильного диагноза. Важно отметить, что в некоторых клинических ситуациях использование эхоконтрастных препаратов при проведении ультразвукового исследования является обязательным условием. История развития эхоконтрастирования. Возможность использовать контрастные препараты при ультразвуковых исследованиях появилась в результате случайного открытия, сделанного в конце 1960-х годов: было обнаружено, что наличие пузырьков газа в циркуляторном русле может значительно повысить интенсивность УЗ-сигнала. Эра применения эхоконтрастных препаратов началась уже в 1968 году. Впервые искусственное эхоконтрастирование было применено в эхокардиографии Pravin V. Shah и R. Gramiak более 35 лет назад. Исследователями был применен контрастный препарат индоциан зеленый, который был введен в полость левого предсердия для определения ударного выброса и длительности раскрытия створок аортального клапана в М-режиме. Первые данные по результатам проведенного исследования были опубликованы в 1968 году. Однако, до 1980 года точный механизм контрастного усиления не был детально изучен и разработан. Лишь в последующих работах R. Kremkau и R. Kerber было доказано, что усиление ультразвукового сигнала обусловлено наличием свободных микропузырьков газа, образующихся в момент инъекции, а также содержащихся в растворе при обычных условиях. После открытия способности микропузырьков газа усиливать ультразвуковой сигнал, началось быстрое развитие эхоконтрастных препаратов. Все образцы имели микропузырьковую основу, являющейся оптимальной для УЗ-контрастирования. На кафедре лучевой диагностики ФГБУ УНМЦ УД Президента РФ были проведены первые в России исследования по изучению возможностей применения эхоконтрастных препаратов в первичной и дифференциальной диагностике опухолей печени, поджелудочной железы, почек, предстательной железы. Физические принципы эхоконтрастирования и поколения эхо-контрастных препаратов. Принцип резонирующего действия эхоконтрастных препаратов (ЭКП) основан на циркуляции в крови ничтожно малых частиц, обладающих акустическими свойствами. Наиболее важными из этих акустических эффектов считают: - усиление отраженного эхо-сигнала; - уменьшение затухания эхо-сигнала; - скорость распространения акустического эффекта; - циркуляцию ЭКП в сосудистой системе или их избирательный захват определенными тканями. Микропузырьки взаимодействуют с ультразвуковым сигналом двояким образом: - энергия ультразвукового излучения разрушает микропузырьки; - при высокочастотном ультразвуковом излучении микропузырьки начинают резонировать и лопаться. В основу использования первого поколения эхоконтрастов был положен физический принцип линейного преобразования отраженного ультразвукового сигнала от микрочастиц («linear microbubble back scatter response). При этом методе используется излучаемая частота низких и средних значений. К недостаткам линейной модели ответа относилось быстрое разрушение микрочастиц контраста, что являлось препятствием для качественной оценки их эффекта. В последнее время в разработке ЭКП доминирующее положение стала занимать нелинейная модель ответа («non-linearbackscatterresponse»). При этом повышение амплитуды ультразвукового сигнала до средних значений приводит к появлению энергии субгармоники, второй, третьей гармоники и т.д. Этот эффект контрастного усиления можно считать аналогичным феномену осцилляции или «вспышки». Во время УЗИ микропузырьки начинают колебаться под воздействием ультразвука. Эти колебания становятся особенно сильным, если частота излучаемой ультразвуковой волны соответствует резонансной частоте микропузырьков. При использовании излучающей волны обычной частоты, получающиеся колебания микропузырьков настолько сильные, что их мембраны разрушаются в течение короткого промежутка времени, что приводит к разрушению самих микропузырьков и выходу газа. Колеблющиеся микропузырьки создают определенный эхо-сигнал с нелинейными характеристиками и особыми частотами. Начало осцилляции происходит, когда микропузырьки увеличиваются в размерах примерно в два раза перед своим разрывом. Под воздействием высокоамплитудного ультразвукового сигнала происходит разрыв микропузырьков, и начинает генерироваться своеобразный акустический сигнал. Эта нелинейная, преходящая, временная реакция получила название «стимулированной акустической эмиссии», которая стала новым направлением развития ЭКП. Мембраны микропузырьков служат границей раздела фаз и обладают высоким уровнем сопротивления давлению. Это приводит к сильному обратному рассеиванию ультразвукового сигнала, выражающемуся в высокой эхогенности микропузырьков. При использовании традиционной технологии УЗИ удается достичь усиления ультразвукового сигнала примерно 30 дБ, что соответствует 1000-кратному усилению. УЗ-аппарат позволяет обнаружить этот особый эхо-сигнал от микропузырьков, несмотря на существенное снижение его интенсивности (по сравнению с обычным ультразвуком) и отличить его от линейного сигнала тканей. Это позволяет эффективно разделять сигнал от контрастного вещества и сигнал от тканей. Ко всем контрастным препаратам предъявляется ряд требований. В первую очередь, для того, чтобы при введении контрастного вещества в периферическую вену, оно прошло через сосуды малого круга кровообращения, размер частиц не должен превышать 8 мкм – диаметр легочных капилляров. Вторым условием является длительность жизни микропузырьков контраста, с учетом того, что время прохождения крови от периферической вены до легочных капилляров составляет около 2 секунд, до левого предсердия – 4-10 секунд, от левого предсердия до других внутренних органов – 4-20 секунд. Следовательно, чтобы провести исследование только на фазе первого прохождения требуется не менее 30-35 секунд жизни УЗ-контраста. За исключением специальных УЗ-контрастов, все используемые контрастные вещества плохо стандартизируемы по размерам микрочастиц, что значительно уменьшает эффективность их использования. К наиболее популярным стандартным УЗ-контрастам относятся Эховист 200, Эховист 300, Левовист и Альбунекс. Эти контрастные вещества отличаются стабильными размерами микропузырьков (2-8 мкм), периодом полужизни – 1-4 мин, и позволяют получать изображения высокого качества. Специальные контрасты Эховист 300, Альбунекс, в качестве контрастного вещества содржат воздух, стабилизированный альбумином (Альбунекс), или покрыты оболочкой из галактозы (Эховист). В отличие от Эховиста, Левовист является мелкодисперсным порошком галактозы с добавлением небольшого количества пальмитиновой кислоты, который при смешивании со стерильной водой для инъекций также образует микропузырьки воздуха, но меньшего, чем Эховист диаметра – в среднем 2 мкм. УЗ-контрасты нового поколения: Эхоген, Аеросомес, BR1 – не содержат воздуха, а в качестве газа используются фторуглеродные соединения. Эти контрасты отличаются большим периодом полужизни, большей концентрацией газа в пузырьке и низкой растворимостью в окружающей среде. Подробнее хотелось бы остановиться на описании эхоконтрастного препарата последнего поколения - Соновью, так как именно этот препарат на сегодняшний день официально зарегистрирован и разрешен к использованию в РФ, а также лицензирован для абдоминальных и сосудистых исследований в Европе и Азии. Соновью - один из самых известных контрастных препаратов для УЗИ, использование которого было одобрено в Европе Европейским агентством по лекарственным средствам (EMA) в 2001 году. С этого времени в мире выполнено более 1,9 миллиона инъекций Соновью. Препарат представляет собой суспензию микропузырьков (диаметром 2,5 мкм), окруженных упругой мембраной фосфолипидов. Микропузырьки наполнены инертным газом с низким уровнем растворимости в воде (гексафторид серы SF6), который при попадании в кровь остается внутри микропузырьков, но легко диффундирует через мембраны альвеол легких и выделяется с выдыхаемым воздухом. Именно поэтому обеспечивается высокая стабильность микропузырьков в кровеносном русле, наряду с быстрым выведением через легочные капилляры. Через 15 минут после введения ЭКП весь введенный объем газа элиминируется с выдыхаемым воздухом. Соновью является препаратом, контрастирующим исключительно сосуды. Это отличает его от рентгеноконтрастных препаратов и парамагнетиков, которые распределяются во всей межклеточной жидкости. Микропузырьки Соновью суспендируют в физиологическом растворе (0,9% раствор хлорида натрия), 1 мл готового к применению препарата состоит из 200 миллионов микропузырьков с общим объемом гексафторида серы 8 мкл. Это небольшое количество газа достаточно для контрастирования всей кровеносной системы в течение нескольких минут. После приготовления 1 флакон содержит 5 мл готовой к использованию суспензии. Нежелательные реакции после введения Соновью как правило легкие, преходящие и разрешаются самостоятельно. В редких случаях возможны реакции гиперчувствительности, которые в исключительных случаях могут быть жизнеугрожающими. Соновью считается высоко безопасным ЭКП и характеризуется низкой частотой нежелательных эффектов. Токсикологические и фармакологические исследования, а также исследования тератогенности этого ЭКП не выявили рисков, связанных с применением у людей. Соновью не является нефротоксичным препаратом и не нарушает функцию щитовидной железы. Эксперименты на животных не выявили повреждающего действия на плод, эмбрио- и фето-токсического эффектов, а также негативного воздействия Соновью на развитие плода и ранее постнатальное развитие. С момента выхода на рынок в 2001 году, нежелательные реакции были зарегистрированы лишь у 0,02%. Частота серьезных нежелательных реакций при применении Соновью с 2001года не изменялась и составляет около 0,01%.Исследования токсичности показали, что в дозировке, в 30 раз превышающей рекомендуемую, он не вызывает никаких побочных реакций, не оказывает действия на центральную нервную и сердечно-сосудистую системы. Противопоказания для использования Соновью, описываемые в научной монографии по применению данного ЭКП, следующие: - гиперчувствительность к компонентам препарата; - острый коронарный синдром; - клинически нестабильная ишемическая болезнь сердца, включая инфаркт миокарда, типичную стенокардию покоя в последние 7 дней, значительное ухудшение течения заболевания сердца в последние 7 дней, недавнюю операцию на коронарных артериях или другие факторы, предполагающие клиническую нестабильность (например, недавнее ухудшение показателей ЭКГ, лабораторных или клинических показателей); - острая сердечная недостаточность III-IV функционального класса по NYHA или тяжелая аритмия; - тяжелая форма легочной гипертензии (легочное артериальное давление выше 90 мм рт. ст.); - неконтролируемая артериальная гипертензия и респираторный дистресс-синдром взрослых; - пациенты, находящиеся на искусственной вентиляции легких; - острый период неврологических заболеваний. В настоящее время разработчики эхоконтрастов ставят себе цель – создание наиболее эхоусиливающих и наименее токсичных сред. Токсичность напрямую зависит от биохимического состава, осмолярности и вязкости веществ, поэтому большинство разрешенных для клинического применения эхоконтрастов содержат бионейтральные, метаболизированные и легко выводимые агенты с осмолярностью ниже, чем у рентгеноконтрастных средств. Что касается повышения эхоусиливающих свойств контрастов, то теоретически любая из пяти сред (несвязанные газовые пузырьки, инкапсулированные газовые пузырьки, коллоидные суспензии, эмульсии и водные растворы) может способствовать достижению указанной цели. Однако сегодня компонентами любого эффективного эхоусиливающего препарата являются именно свободные и инкапсулированные газовые пузырьки. Эхоконтрастирование используется для диагностики в кардиологии, гинекологии, урологии, онкологии, нейрохирургии и неврологии, при проведении транскраниальной доплерографии. Недавние исследования показали, что использование контрастных препаратов в УЗИ имеет большие перспективы в оценке терапии опухолевых образований различных локализаций. Среди существенных достоинств методики можно выделить следующие: - относительная простота выполнения исследования; - возможность проведения исследования в реальном масштабе времени; - отсутствие лучевой нагрузки; - возможность многократного повторения исследования при динамическом наблюдении за пациентами; - исследование может проводиться у постели больного, а также в условиях отделения реанимации и интенсивной терапии; - при сравнении с контрастами при МРТ, ультразвуковые контрастные препараты не обладают нефротоксичностью. Газ, содержащийся в микропузырьках, метаболизируется и выводится через легкие, в связи, с чем неблагоприятные реакции со стороны пациентов очень редки. Это особенно важно для реципиентов при трансплантации внутренних органов, в частности для пациентов с почечной недостаточностью; - преимуществом УЗИ с использованием контрастного вещества также является возможность для непрерывного изучения очага поражения в течение всего периода исследования (в режиме реального времени). Таким образом, методика контрастного усиления при ультразвуковом исследовании представляются весьма многообещающими при поиске и дифференциальной диагностике опухолей различных локализаций, изучении кровотока в различных органах, повышая информативность ультразвуковой методики. Диагностические возможности ультразвукового метода в этом случае трудно переоценить, так как информативность эхоконтрастирования чрезвычайно высока, а сама методика относится к безвредным и неинвазивным процедурам. * Медицинская визуализация №1/2015 Список литературы 1. Фомина С.В., Завадовская В.Д., Юсубов М.С. и др. Контрастные препараты для ультразвукового исследования. Бюллетень сибирской медицины. 2011; 6: 137-141. 2. Зубарев А.В. Современная ультразвуковая диагностика: теория и практика. Радиология – практика. 2008; 5: 1-14. 3. Schröder R.J., Bostanjoglo M., Hidajat N. et al. Analysis of vascularity in breast tumors – comparison of high frequency ultrasound and contrast-enhanced color harmonic imaging. Rofo. 2002; 174: 1132–1141. 4. Algül A., Balci P., Seçil M. et al. Contrast enhanced power Doppler and color Doppler ultrasound in breast masses: Efficiency in diagnosis and contributions to differential diagnosis. Tani Girisim Radyol. 2003; 9: 199–206. 5. Kook S.H., Kwag H.J. Value of contrast-enhanced power Doppler sonography using a microbubble echo-enhancing agent in evaluation of small breast lesions. J Clin Ultrasound. 2003; 31: 227–238. 6. Зубарев А.В., Гажонова В.Е. Диагностический ультразвук. Уронефрология. Практическое руководство. 2002: 8-22. 7. Gramiak R., Shah P.M. Echocardiography of the aortic root. Invest. Radiol. 1968; 3: 356 –366. 8. Kremkau F.W., Gramiak R., Carstens E.L. et al. Ultrasonic detection of cavitation at catheter tips. Am. J. Roentgenol. RadiumTher. Nucl. Med. 1970; 110: 177 –183. 9. Kerber R., Kioschos J., Lauer R. Use of ultrasonic contrast method in the diagnosis of valvular regurgitation and intracardiac shunts. Am J Card. 1974; 34:722-7. 10. Greis C.H., Technology overview: SonoVue (Bracco, Milan). Eur Radiol. 2004; 14 (8): 11-15. 11. Соновью. Научная монография. Динамическое контрастное усиление в режиме реального времени. 2013: 6-40. 12. Seidel G., Meyer K. Impact of ultrasound contrast agents in cerebrovascular diagnostics. Eur J Ultrasound. 2002; 16 (1-2): 81-90. 13. Волков В.Н. Основы ультразвуковой диагностики. Учеб.-метод. Пособие. – Мн.: ГрГМУ. 2005; 13-15. 14. Claudon M., Cosgrove D., Albrecht T. et al. Guidelines and good clinical practice recommendations for contrast enhanced ultrasound (CEUS) - update 2008. UltraschallMed 2008; 29:28-44. 15. Morel D.R., Schwieger I., Hohn L. et al. Human pharmacokinetics and safety evaluation of SonoVue, a new contrast agent for ultrasound imaging. Invest Radiol. 2000; 35(1):80-85. 16. SonoVue Periodic Safety Update Report, September 2011; 29-32 17. Демин И.Ю., Прончатов-Рубцов Н.В. Современные акустические методы исследований в биологии и медицине. Учебно-методические материалы по программе повышения квалификации «Хранение и обработка информации в биологических системах». Нижний Новгород. 2007; 20-22. 18. Lavisse S. Early quantitative evaluation of a tumor vasculature disruptive agent AVE 8062 using dynamic contrast-enhanced ultrasonography. Invest. Radiol. 2008; 43: 100–111. 19. Lassau N., Koscielny S., Chami L. et al. Advanced hepatocellular carcinoma: early evaluation of response to therapy at dynamic contrast enhanced US with quantification-preliminary results. Radiology. 2011; 258: 291–300. 20. Claudon M., Cosgrove D., Albrecht T. et al. Guidelines and good clinical practice recommendations for contrast enhanced ultrasound (CEUS) - update 2008. Ultraschall Med 2008; 29:28-44. 21. Glockner JF, Forauer AR, Solomon H, Varma CR, Perman WH. Three dimensional gadolinium enhanced MR angiography of vascular complications after liver transplantation. AJR Am J Roentgenol 2000;174:1447-1453.
18 ноября 2015 г.
Ещё больше полезной информации на нашем Телеграм-канале