На сегодняшний день доказанным и неоспоримым фактом является практически облигатное возникновение у пациентов в послеоперационном периоде иммунодефицитного состояния, выраженного в большей или меньшей степени и являющегося следствием воздействия целого ряда факторов (Б. С. Брискин с соавт. , 1989). Также общеизвестно, что именно функционирование иммунной системы в значительной степени определяет течение послеоперационного периода, сроки реабилитации и даже исход заболевания. Типичным примером могут являться возникающие на фоне иммунодефицита послеоперационные инфекционные осложнения. Фактом, во многом определяющим и однозначно усугубляющим послеоперационные девиации иммунной системы, является исходный предоперационный иммунодефицит, связанный с гипотрофией пациентов, с основным заболеванием и его осложнениями (в особенности — инфекционного характера), с сопутствующей патологией. Прогрессирующие иммунодефицитные состояния нередко сопровождаются злокачественной трансформацией тканей и генерализацией уже имеющегося опухолевого процесса с интенсивным метастазированием. Закономерно в этой связи, что операционный стресс, подавляя иммунитет, создает условия для локального и системного прогрессирования онкопроцессов.
Механизмы иммунологических изменений многообразны, однако бесспорно, что они являются неотъемлемой частью всего комплекса патофизиологических реакций послеоперационного периода, инициируемые одними и теми же триггерами альтерации и физиологического стресса и имеющими тесную связь с процессами катаболизма. Основными инициаторами иммунных реакций в послеоперационном периоде являются вышеописанные эндокринные изменения, которые воздействуют на составляющие иммунитета через активацию симпатоадреналовой, ренин-ангиотензин-альдостероновой систем, освобождение антидиуретического гормона и нарушение утилизации глюкозы. Как в норме, так и на фоне развития различных патологических процессов, на функционирование иммунной системы влияют адренокортикотропный гормон (АКТГ), соматотропный гормон, кортикостероиды, инсулин.
Одним из триггерных механизмов, реализующих иммуносупрессию у хирургических больных, является гиперфункция коры надпочечников при активации всей гипоталамо–гипофизарно–надпочечниковой системы. Большинство исследователей иммуносупрессию при хирургическом стрессе связывают именно с усилением секреции АКТГ гипофизом, что приводит к увеличению концентрации глюкокортикоидов в плазме при усилением их выработки в коре надпочечников. При этом высокие концентрации глюкокортикоидов ингибируют развитие воспалительной реакции, вызывают деградацию и гибель лимфоцитов и плазматических клеток, особенно снижая количество Т-лимфоцитов, главным образом, за счет уменьшения доли Т-хелперов, а также уменьшают число эозинофилов. Кроме этого показано, что АКТГ способствует снижению миграционной способности лимфоцитов периферических лимфатических узлов, селезенки, тимуса, а также тормозит миграцию стволовых клеток и В-лимфоцитов из костного мозга.
Кортизол реализует свое противовоспалительное и иммуносупрессивное действие посредством снижения синтеза цитокинов, простагландинов и гистамина, затруднением адгезии макрофагов и моноцитов в очаге повреждения, а также уменьшением эффективность фагоцитоза. Тем не менее традиционной мишенью для стероидных гормонов коры надпочечников является именно лимфоидная ткань. Экспериментально показано, что экзогенные кортикостероиды могут снижать количество лимфоцитов (главным образом за счет снижения доли Т-хелперов) в периферической крови до 50–70 % от нормы, с чем, собственно во многом и связывают иммуносупрессивные свойства этих гормонов. При этом на первых этапах развития лимфопении эффект кортикостероидов обусловлен не столько гибелью лимфоцитов, сколько их выходом из циркуляции. Т-лимфоциты рециркулируют в костный мозг, подавляется выход Т-лимфоцитов в кровоток из тимуса, а В-лимфоцитов - из костного мозга. Доказано, что в наибольшей степени к действию глюкокортикоидов чувствительны клетки центрального органа иммунитета - тимуса: в нем происходит массовая гибель кортикальных незрелых тимоцитов, несущих двойной антигенный маркер – CD4+ (T-хелперы), CD8+ (Т-киллеры). В периферических лимфоидных органах апоптозу подвергаются как Т-, так и В-лимфоциты, причем первые более чувствительны к этому виду гибели по сравнению со вторыми. Кроме того кортизол изменяет баланс Т-хелперов в сторону преобладания TH2-клеток, ответственных за контроль гуморального иммунитета. Повышение количества Th2 пропорционально выраженности операционной травмы и влечет за собой, в конечном итоге, возникновение дефицита NK-клеток и предрасположенность к микробной инвазии.
Повышение содержания эндогенных катехоламинов обусловливает увеличение содержания в периферической крови нейтрофилов и лимфоцитов, а также изменения их мобилизации и разрушения. Большую часть лимфоцитов, включающихся в циркуляцию при гиперкатехоламинемии, многие авторы именуют “стрессовыми лимфоцитами", так как функционально и морфологически они отличаются от нормальных популяций. При этом снижается процент Т-хелперов при сохраняющемся проценте Т-супрессоров. Одним из следствий повышенной секреции катехоламинов является активация перекисного окисления липидов с накоплением продуктов свободно-радикального окисления, повреждающими биологические мембраны клетки. В результате происходит повреждение важнейших регуляторных механизмов клеток, в том числе и лейкоцитов: нарушаются рецепторная и транспортная функции мембран, контактные свойства клеточных поверхностей и, что самое важное — межклеточные взаимодействия.
К гормонам, оказывающим противоположное, иммуностимулирующее действие, относят соматотропный гормон и инсулин. Соматотропный гормон оказывает активное влияние на лимфоидную ткань за счет его специфической активации тимуса. Экспериментально показано, что введение в организм экзогенного соматотропного гормона вызвает стимуляцию как гуморальных, так и клеточных иммунных реакций. Известно, что лимфоциты имеют два вида рецепторов для инсулина: гормональный рецептор для метаболических функций, находящийся на всех активированных лимфоцитах, и иммунологический рецептор, расположенный на Т- и В-лимфоцитах. При этом инсулин усиливает цитолитический эффект у сенсибилизированных Т-киллеров. С другой стороны, некоторые авторы иммуностимулирующий эффект инсулина связывают не столько с прямым действием на лимфоциты, сколько с предотвращением иммуносупрессивного влияния гипергликемии.
Таким образом в условиях стрессорных влияний операционной травмы отчетливое иммуносупрессивное действие оказывает АКТГ и кортикостероиды. Несмотря на то, что прямое влияние катехоламинов на различные механизмы функционирования иммунной системы требуют дальнейших исследований, большинство авторов сходятся на наличии опосредованного влияния катехоламинов на иммунитет, такого, например, как стимуляция секреции кортикостероидов. Анаболические агенты инсулин и соматотропный гормон, напротив, оказывают иммуностимулирующий эффект.
Катаболический тренд обмена веществ в послеоперационном периоде и связанная с ним белково-энергетическая недостаточность являются причиной дисфункции всех компонентов иммунной системы — фагоцитоза, гуморального и клеточного иммунитета. Взаимосвязь иммунитета и послеоперационной нутритивной недостаточности по мнению подавляющего большинства исследователей настолько очевидна, что отдельные показатели состояния иммунной системы используются для оценки динамики нутритивного статуса у оперированных пациентов (см. ниже).
Изменения фагоцитарного звена иммунитета в катаболической фазе послеоперационного периода имеют как количественный, так и качественный характер. Количественные изменения наиболее простые и заключаются в понижении числа основных фагоцитирующих клеток - нейтрофилов и моноцитов. Значительно более сложными являются качественные изменения фагоцитоза, а именно хемотаксис, адгезия, активация мембраны, образование фагосомы, киллинг и расщепление микроорганизма. Механизм подавления кислородзависимого киллинга связан с недостаточным энергообеспечением фагоцитов. При этом в результате дефицита свободных кислородных радикалов в активированных фагоцитах объекты фагоцитоза не уничтожаются. Известно, что многие патогенные микроорганизмы содержат каталазу, инактивирующую перекись водорода. После фагоцитоза таких бактерий нейтрофилами с недостаточной активностью глюкозо-6-фосфатдегидрогеназы в фагосомах вообще не образуются активные соединения кислорода, из действия которых во многом состоит бактерицидный эффект фагоцитов. В результате фагоцитоз оказывается незавершенным, уничтожения патогенных микроорганизмов и элиминации продуктов деструкции не происходит. Многие авторы отмечают, что в послеоперационном периоде в наибольшей степени страдает та популяция фагоцитарных клеток, которая ближе всего расположена к месту вмешательства: альвеолярных макрофагов при операциях на легких, клеток Купфера при операциях на печени. При этом наступает существенное уменьшение экспрессии HLA-DR и HLA-DQ антигенов на этих клетках, отвечающих за презентацию антигенных детерминант, следствием чего является пониженная способность организма развивать последующий специфический иммунный ответ (И. П. Назаров и соавт. , 2006).
Белково-энергетическая недостаточность, присущая послеоперационному периоду, сопровождается снижением количества лимфоцитов в периферической крови. Наблюдается преимущественное уменьшение числа CD3+ Т-лимфоцитов при относительно стабильном содержании В-лимфоцитов и увеличении доли нулевых клеток. Считается, что среди Т-лимфоцитов белковому голоданию наиболее подвержены CD4+ лимфоциты. На фоне снижение общего уровня Т-лимфоцитов в периферической крови отмечается снижение Th0 лимфоцитов в результате увеличения числа Th2 лимфоцитов.
В ходе клинических исследований была установлена корреляция между уровнем альбумина плазмы и числом лимфоцитов периферической крови: при снижении уровня альбумина наблюдалось уменьшение как относительного, так и абсолютного содержания CD25+ клеток. Помимо этого снижение уровня альбумина приводило к уменьшению пролиферативной активности лимфоцитов в ответ на Т-клеточные митогены и синтеза ряда цитокинов (IL-1, IL-2, IFN, MIF). Так, происходит существенное понижение способности Т-клеток продуцировать один из центральных цитокинов иммунной системы – IL-2, наблюдаемое как правило на 3 сутки послеоперационного периода. Выраженность и продолжительность этого процесса зависит от длительности операции, ее травматичности и факта гемотрансфузий (Ю. С. Винник и соавт. , 2004).
Послеоперационные изменения со стороны гуморального иммунитета в целом характеризуются снижением антителообразования и угнетением пролиферативной активности лимфоцитов. При исследовании связи нутритивного и иммунного статуса отмечено, что уровень IgA в сыворотке и количество циркулирующих в крови CD4+ лимфоцитов прямо коррелирует с основными антропометрическими показателями, характеризующими нутритивный статус пациента. Изменения гуморального иммунитета заключаются в понижении уровня иммуноглобулинов IgA и IgM и, что особенно важно - главного компонента гуморального иммунитета - IgG.
Как правило, максимум иммунодепрессии практически по всем параметрам иммунной системы наблюдается на 2-й день после операции и в зависимости от характера и объема этой операции, а также исходного состояния больного ее длительность может составлять от одной до четырех недель.
Возникающие в послеоперационном периоде девиации иммунной системы от гипервоспаления до иммунносупрессии большинство современных исследователей объясняют с точки зрения нарушения баланса между про- и противовоспалительными цитокинами. Как известно продукция провоспалительных медиаторов, являясь изначально типичной защитной реакцией, при чрезмерной активации может привести к развитию синдрома системной воспалительной реакции (ССВР) с последующими критическими нарушениями гемоперфузии и развитием синдрома полиорганной недостаточности (СПОН). С другой стороны призванный компенсировать гипервоспаление противоспалительный медиаторный ответ также может играть крайне неблаговидную роль, открывая возможности для развития назокомиальных инфекций и опухолевой прогрессии на фоне развивающейся иммуносупрессии. Очевидно, что именно деликатная регуляция продукции медиаторов с противоположными биологическими эффектами позволяет организму поддерживать иммунный гомеостаз на тонкой грани, разделяющей гипервоспаление и иммуносупрессию (см. табл. 1).
Таблица 1. Медиаторы воспалительного ответа.
Провоспалительные цитокины | Противовоспалительные цитокины | Белки острой фазы |
Фактор некроза опухолей TNF-α Интерлейкин IL-1 Интерлейкин IL-2 Интерлейкин IL-6 Интерлейкин IL-8 Интерферон INF-γ | Интерлейкин IL-10 Простагландин PgE2 Трансформирующий фактор роста TGF-бета Интерлейкин IL-4 | Α-химотрипсин Комплемент С3 Церулоплазмин Фибриноген Гаптоглобин С-реактивный белок СRP Прокальцитонин |
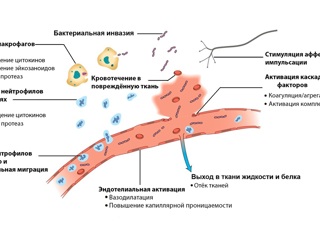
Непосредственно в момент повреждения тканей развивается типичная локальная воспалительная реакция на повреждение (рис. 2. 10. ) с высвобождением из тканевых макрофагов и эндотелиальных клеток провоспалительных цитокинов IL-1 и TNF-α. Далее указанные цитокины активируют местный и системный воспалительный каскад, призванный контролировать прогрессию тканевого повреждения, элиминировать патогены и в целом направленный на поддержание гомеостаза (см. табл. 2).
Таблица 2. Влияние IL-1 и TNF-α на воспалительный процесс.
Местное действие | Системное действие |
Стимуляция синтеза молекул адгезии | Гипертермия |
Миграция нейтрофилов в очаг повреждения | Активация гипоталамо-гипофизарно-надпочечниковой системы |
Повышение сосудистой проницаемости | Гиперкоагуляция |
IL-1 и TNF-α оказывают триггерный эффект на вторичное высвобождение IL-6, коррелирующее со степенью хирургической травмы и оказывающее влияние как на про-, так и на противовоспалительные реакции (см. табл. 3)
Таблица 3. Про- и противовоспалительные эффекты IL-6.
Провоспалительное действие | Противовоспалительное действие |
Синтез белков острой фазы в печени: - С-реактивный белок -иммуносупрессивный кислый протеин (IAP) | Увеличение синтеза глюкокортикоидов |
Увеличение пролиферации полиморфноядерных лейкоцитов и эффективности оксидативных реакций | Снижение синтеза провоспалительных цитокинов IL-1 и TNF-α |
Гиперпродукция IL-6 определяет прогрессирование хронических воспалительных заболеваний: - ревматоидный артрит - болезнь Крона - ювенильный идиопатический артрит | Индукция синтеза макрофагами простагландина E (PgE2) - эйкозаноида с потенциально иммуносупрессивным действием |
Ранний воспалительный ответ, возникающий непосредственно после действия альтерирующего фактора, является результатом доминирования цитокинов, продуцируемых Th1-клетками — IL-2, IL-12, INF-γ. Другие цитокины, продуцируемые Th1-клетками, TNF-α и IL-1β, а также IL-12, продуцируемый макрофагами, являются мощными активаторами Т-лимфоцитов и клеток фагоцитарной системы (как нейтрофилов, так и моноцитов/макрофагов). Тем не менее операционная травма также приводит и к повышению секреции глюкокортикоидов, катехоламинов, белков острой фазы воспаления. Эти медиаторы в свою очередь приводят к смещению акцентов доминирования с Th1-клеток на Th2-клетки и продукцией последними цитокинов IL-4, IL-5, IL-6, IL-10, IL-13. Эффекты данных цитокинов реализуются возникновением депрессии клеточного звена иммунитета и, следовательно, функциональной активности фагоцитарных клеток в послеоперационном периоде (см. табл. 4).
Таблица 4. Роль цитокинов в иммунных реакциях послеоперационного периода.
Цитокины | Действие |
Провоспалительные IL-1, IL-6 | - стимуляция синтеза белков острой фазы - эффекты модулируется кортизолом |
Провоспалительные IL-2, INF-γ | - ингибируют синтез PgE2 |
Противовоспалительный PgE2 | - ингибирует Th1-клетки, продуцирующие IL-2, INF-γ - стимулирует Th2-клетки, продуцирующие IL-4, IL-10 |
Противовоспалительный TGF-бета | - ингибирует Th1-клетки, продуцирующие IL-2, INF-γ - стимулирует Th2-клетки, продуцирующие IL-4, IL-10 |
Противовоспалительные IL-4, IL-10 | - снижают экспрессию антигенов MHC II моноцитами и лимфоцитами |
Таким образом первопричиной послеоперационной иммуносупрессии и развития инфекционных осложнений следует считать дисбаланс в популяции Т-хелперов с повышением функциональной активности Тh2-клеток и реципрокным понижением функциональной активности Th1-клеток. С другой стороны существенное интра- и послеоперационное повышение активности субпопуляции Th1-клеток TH1-хелперов ведет к развитию других, не менее серьезных осложнений. Как только что отмечалось, эти клетки синтезируют ИЛ-1β и ФНО-α. Напомним, что эти цитокины являются провоспалительными и главными факторами в развитии ССВР, СПОН и сепсиса.
Одним из последствий гиперпродукции провоспалительных цитокинов TNF-α, IL-1, IL-2, IL-6, IL-8, INF-γ является усугубление нарушений углеводного обмена вследствие инсулинорезистентности, что иллюстрирует связь послеоперационного иммунного ответа и метаболических изменений. Как было показано в предыдущих разделах инсулинорезистентность является ключевым звеном в возникновении послеоперационных нарушение углеводного обмена и связанных с этим осложнений. Первичное возникновение послеоперационной инсулинорезистентности принято считать следствием комплекса нейро-эндокринных изменений, характеризующих ответ на операционную травму. При этом гипергликемия приводит к избыточному поступлению шлюкозы в митохондрии, что в свою очередь блокирует гликолитические реакции и реакции цикла Кребса. Возникающий при избытке глюкозы парадоксальный энергодефицит приводит к усилению продукции провоспалительных цитокинов, имеющей своей целью усиление катаболизма и мобилизацию энергетических субстратов. Это приводит к усугублению гиперликемии при сохраняющейся инсулинорезистентности, порочный круг оказывается замкнутым (A. Thorell, 2006; W. Souba, 1994).
На возникновение нарушений со стороны иммунной системы, помимо собственно операционной травмы, оказывают существенное влияние и целый ряд периоперационных факторов: кровопотеря и гемотрансфузии, анестезиологическое пособие. Так, установлено, что под влиянием кровопотери достоверно уменьшается активность фагоцитирующих клеток при снижении экспрессии на мембране перитонеальных и селезеночных макрофагов HLA-DR. Эта функциональная недостаточность макрофагов может быть связана с их неспособностью аккумулировать ионы кальция, играющие ключевую роль в активации клеток. Не исключено, что следствием данного дефекта в функционировании макрофагов под влиянием кровопотери является и нарушение секреции этими клетками цитокинов IL-1, IL-2, IL-3, IL-6, TNF-α, INF-γ с последующими нарушениями клеточного и гуморального звеньев иммунитета.
Периоперационная гемотрансфузия по данным подавляющего большинства исследователей оказывает выраженный иммуносупрессивный эффект. Механизмы посттрансфузионной иммуносупрессии весьма вариабельны. В ряде работ показано, что переливание аллогенной крови усиливает активность Тh2-клеток, с последующей стимуляцией гуморального и ингибицией клеточного иммунитета. Имеются данные о том, что в первые несколько суток после гемотрансфузии у пациентов наблюдается снижение общей популяции Т-лимфоцитов, преимущественно Т-хелперов (CD4) и Т-супрессоров (CD8), и В-лимфоцитов, а также уменьшение интенсивности пролиферативного ответа лимфоцитов на стимуляцию Т-митогенами. При этом указанные явления сохранялись у пациентов, спустя два и даже три месяца после операции.
Ряд ингаляционных и внутривенных средств для наркоза также могут оказывать существенное влияние на функционирование иммунной системы после операции (см. табл. 5).
Таблица 5. Влияние средств для анестезии на иммунную систему.
Препарат | Влияние на иммунитет |
Ингаляционные анестетики (оксид азота, изофлюран, севофлюран) | - уменьшение нейтрофильного фагоцитоза и продукции нейтрофилами активных форм кислорода - уменьшение макрофагального фагоцитоза - снижение продукции иммуноглобулинов - индукция апоптоза лимфоцитов - снижение цитотоксической активности NK-клеток |
Пропофол | - уменьшение нейтрофильного фагоцитоза и продукции нейтрофилами активных форм кислорода - уменьшение хемотаксиса и макрофагального фагоцитоза - ингибирование провоспалительных цитокинов макрофагами - минимальное влияние на лимфоциты - не оказывает супрессивного влияния на NK-клетки |
Морфин и другие природные опиоиды | - ингибирование нейтрофильного фагоцитоза - ингибирование пролиферации и созревания макрофагов - снижение секреции макрофагами IL-10 и IL-12 - снижение продукции иммуноглобулинов - снижение секреции Th1-клетками IL-2, INF-γ - ингибирование лимфоцитарной пролиферации - снижение активности NK-клеток |
Обращает на себя внимание выраженный иммуносупрессивный эффект морфина и других природных опиоидов. Этот эффект морфина связан с его воздействием на μ-3 рецепторы иммунокомпетентных клеток, приводящим к дезактивации последних. В отличие от морфина синтетические опиоиды не действуют на μ-3 рецепторы и потому не оказывают значимого влияния на иммунную систему. Хорошо известный иммунопротективный эффект регионарной анестезии обусловлен закономерным снижением активации нейро-эндокринной системы вследствие снижения афферентных влияний при достижении регионарного блока. При этом закономерно снижается стресс-индуцированная продукция кортизоола и, как результат, сохраняется в нормальных пределах лимфоцитарная пролиферация, баланс Th1/Th2-хелперов и функциональная активность NK-клеток.
Выраженный воспалительный ответ и последующая иммунодепрессия после операции является очевидным и объективным предрасполагающим фактором возникновения инфекционных осложнений. При этом, поскольку выраженность иммунологических изменений четко коррелирует со степенью операционной травмы, применение минимально инвазивных технологий оперирования является вполне обоснованным и с точки зрения теоретически обоснованного снижения риска инфекционных осложнений. Как было указано выше послеоперационный иммунный ответ имеет многофакторную подоплеку и пролонгированное течение. Практически немедленно после начала операции одновременно резко повышается продукция провоспалительных цитокинов Th1-клеток (IL-6 и TNF-α) и секреция кортикостероидов. Однако уже через один — два часа после окончания операции уровень продуцируемых Th1-клетками цитокинов падает с одновременным ростом уровня цитокинов Th2-клеток — IL-10 и TGF-β. Как было указано выше, именно этот дисбаланс Th1/Th2 цитокинов определяет дальнейший диссонанс в функционировании иммунной системы и развитие инфекционных осложнений, а послеоперационное повышение уровня IL-10 является предиктором возникновения СПОН и сепсиса. Помимо этого в течение всей операции отмечается постепенное снижение числа Т-лимфоцитов, коррелирующее с травматичностью вмешательства и кровопотерей. При этом отмечается снижение митотической и пролиферативной активности Т-лимфоцитов, а также уменьшение продукции этими клетками цитокинов. Неоднократно отмечено, что именно пациенты с выраженной депрессией Т-клеточного звена иммунитета являются наиболее восприимчивыми к инвазии микробных агентов. Депрессия антигенпрезентирующей функции макрофагов в послеоперационном периоде является еще одним независимым фактором развития инфекционно-септических осложнений. В свою очередь к факторам, индуцирующим эту депрессию, относят повышение продукции простагландинов, оксида азота и противовоспалительных цитокинов.
Еще одним важным моментом, характеризующим состояние иммунной системы в послеоперационном периоде, является противоопухолевый иммунитет. Одним из поводов акцентирования внимания на данной проблеме явилась хорошо известный хирургам и онкологам и ранее считавшийся феноменом факт индукции оперативным вмешательством, даже имеющим признаки радикальности, локального прогрессирования опухоли и ее метастазирования. В основе данного факта лежит доказанное сочетанное действие операционной травмы, нейро-эндокринной реакции и анестезии (в особенности — с применением опиоидов) на основу противоопухолевого иммунитета — NK-клетки, а именно — ингибирование их функции. В ходе клинико-экспериментальных исследований было показано крайне негативное влияние целого ряда средств для наркоза на популяцию NK-клеток. К таким препаратам в первую очередь относятся кетамин, тиопентал, галотан, чья способность инуцировать локальные рецидивы и генерализацию опухолевого процесса на сегодняшний день доказана. Помимо этого в качестве факторов, также негативно влияющих на функцию NK-клеток, рассматривают различные виды стресса и гипотермию. Для поддержания противоопухолевого иммунитета, так же как и для контроля над инфекционным процессом, принципиально важно поддержание баланса между Th1- и Th2-клетками. Доминирование Th2-клеточной активности в послеоперационном периоде связано с высоким риском опухолевой прогрессии. При этом некоторые авторы обращают внимание, что именно этот вариант активности наблюдается у пациентов, оперированных по поводу новообразований пищеварительного тракта. Маркерами депрессии противоопухолевого, так же как и противомикробного иммунитета служат повышение уровня IL-6 и иммуносупрессивного кислотного протеина (IAP). Последний, будучи впервые выделенный из асцитической жидкости при карциноматозе брюшины, обладает способностью индуцировать рост опухоли при супрессии противоопухолевого иммунного ответа. В этой связи следует признать, что хирургическое вмешательство, являющееся на сегодняшний день основой лечения для большинства пациентов с солидными новообразованиями, имеет и свою иммунологическую «The dark side of the Moon» вследствие обусловленного нейро-гуморальной реакцией на операционную травму диссонанса в продукции цитокинов и супрессии NK-клеток.
Резюмируя сказанное, следует подчеркнуть, что послеоперационные изменения иммунного статуса являются неотъемлемой частью всего комплекса патофизиологических реакций послеоперационного периода. Наличие общих триггерных механизмов, инициирующих изменения и в иммунной системе, и в обмене веществ, наличие общих медиаторов, потребность иммунной системы в энергии и пластических субстанциях делают иммунитет и метаболизм звеньями одной цепи гомеостатических изменений послеоперационного периода. При этом критические изменения метаболических процессов, находящихся в тренде катаболизма, закономерно сопровождаются крайними в своей выраженности изменениями иммунитета от глубокой иммуносупрессии, сопровождаемой развитием инфекционных осложнений, до гиперактивации иммунной системы с развитием ССВР.
20 февраля 2016 г.
Ещё больше полезной информации на нашем Телеграм-канале