Рассмотрение побочных эффектов нестероидных противовоспалительных препаратов (НПВП) со стороны пищеварительного тракта в подавляющем большинстве случаев предполагает обсуждение очевидных негативных последствий их применения – кровотечения, перфорации, острой печеночной недостаточности. Однако, как это ни странно побочные эффекты терапии НПВП могут иметь и позитивное значение. Ярким примером этому служит выявленный в последние десятилетия феномен предотвращения злокачественной трансформации толстокишечных полипов при терапии НПВП, проводимой по поводу локальной или системной воспалительной реакции.
На сегодняшний день возможность профилактики развития рака ободочной и прямой кишки некоторыми НПВП является доказанным фактом. Более того, в ряде государств, помимо ревматической и неврологической патологии, показанием для назначения отдельных НПВП (например, целекоксиба) служит профилактика развития колоректального рака. Много ли найдется препаратов (не чудодейственных пищевых добавок, а лекарственных средств с четко обозначенным механизмом действия), способных предотвращать возникновение злокачественных опухолей? Риторический характер данного вопроса сам по себе показывает исключительную важность обсуждения этого «побочного эффекта» НПВП. Целесообразность отдельного обсуждения возможностей применения НПВП для профилактики колоректального рака (КРР) определяется особенно актуальной для онкологической, хирургической и гастроэнтерологической клиник необходимостью поиска новых методов и средств для улучшения результатов лечения больных с новообразованиями толстой и прямой кишки. Для правильного понимания всей важности проблемы и реальных перспектив использования НПВП для химиопрофилактики КРР следует, прежде всего, представить особенности современной эпидемиологии КРР и предраковых состояний, а также возможности диагностики и результаты лечения больных с указанной патологией.
Под термином колоректальный рак (КРР) объединяются различные по форме, локализации и гистологической структуре злокачественные эпителиальные опухоли слепой, ободочной и прямой кишок, а также анального канала. По мнению экспертов ВОЗ, к настоящему времени КРР во многих странах мира приобрел характер эпидемического заболевания. В общей структуре онкологических заболеваний КРР занимает по частоте третье и по смертности второе место после рака легких. Ежегодно в мире регистрируется от 500 тысяч до 1 миллиона вновь выявленных случаев рака толстой и прямой кишки. По данным В. И. Чиссова и соавт. (1997) в России за последние 20 лет КРР в общей структуре заболеваемости злокачественными новообразованиями переместился с шестого на четвертое место у женщин и на третье место у мужчин, уступая лишь раку легкого, желудка и молочной железы: ежегодно регистрируется более 40 тыс. новых случаев рака толстой кишки (за 2000 год 47530 – первичных больных, умерло 34341 пациентов). Аналогичная динамика заболеваемости КРР отмечена и в США. Так, в 1994 г. было выявлено 149 тыс. новых случаев заболевания, часть из которых не была диагностирована на ранних стадиях, когда лечение еще возможно, а более 56 тыс. случаев закончились летально. В 1995 г. в США было выявлено уже около 152 тыс. новых случаев, из которых по крайней мере 57 тыс. закончились летально. Для сравнения: в 1985 г. в США было зарегистрировано всего 38 тыс. новых случаев, из которых в 96 тыс. случаев процесс был локализован в толстой кишке, а в 44 тыс. случаев - в прямой кишке. При этом, если в 1985 г. смертность от КРР составила 13, 5% от общего числа летальных исходов, обусловленных онкологическими заболеваниями, то к 1991 г. данный показатель составил уже более 17%. Неуклонное нарастание частоты КРР наблюдается во всех развитых странах, в равной степени у всех этнических групп. У женщин несколько чаще встречается рак ободочной кишки, у мужчин - рак прямой кишки. Риск развития КРР связан с возрастом. Так, если возрастная группа моложе 40 лет составляет не более 5% от всех случаев данной патологии, то абсолютный максимум из всей группы больных с КРР приходится на лиц старше 50 лет [1, 3, 4, 6, 10, 11, 12, 30, 49].
В структуре смертности от злокачественных новообразований на долю рака ободочной кишки приходится 4, 3% у мужчин и 7, 9% у женщин, прямой кишки — 4, 2% и 6, 1% соответственно. Тревожным является тот факт, что на 100 новых больных КРР приходится более 70 умерших, из них на 1-м году с момента установления диагноза – около 40%. Данное обстоятельство обусловлено тем, что при первичном обращении пациентов к врачу запущенные формы рака (III-IV стадии) диагностируются у 71, 4% больных раком ободочной кишки и у 62, 4% в случаях заболевания раком прямой кишки.
Отдаленные результаты лечения больных ранними стадиями рака ободочной кишки вполне удовлетворительны. При опухолях, ограниченных слизистой оболочкой, пятилетнее выздоровление достигается у 85-100% оперированных. Выживаемость больных раком ободочной кишки II стадии снижается до 70%. Еще хуже отдаленные результаты лечения больных с III стадией, особенно при наличии множественных метастазов в лимфатические узлы (около 30% 5-летних выздоровлений). Больные с неоперабельной опухолью остаются в живых на протяжении 5 лет в единичных случаях. Лица, отказавшиеся от оперативного лечения, а также больные с отдаленными метастазами погибает в сравнительно короткий срок. Лучевое и лекарственное лечение существенного продления жизни не дает [3, 4, 11].
Очевидно, что прогноз при КРР определяется стадией опухолевого процесса. Первая клиническая классификация КРР была предложена еще в 1926 г. J. Lockhart-Mummery, она содержала три стадии – А, В, С и была основана лишь на данных интраоперационной ревизии. В 1932 г. С. Dukes предложил классификацию, при которой стадии процесса устанавливались не только по клиническим данным, но и с учетом сведений, полученных при патоморфологических исследованиях удаленных операционных препаратов. При этом принималось во внимание глубина инфильтрации опухолью кишечной стенки и наличие метастазов в регионарных лимфатических узлах. Модифицированная в 1967 году Turnbull классификация Dukes сегодня является наиболее распространенной у зарубежных хирургов и онкологов:
Стадия А – опухоль ограничена стенкой кишки без прорастания в окружающие ткани и без метастазов в регионарные лимфатические узлы;
Стадия В – опухоль прорастает в окружающие ткани, но отсутствуют метастазы в регионарных лимфатических узлах;
Стадия С1 – опухоль с или без прорастания в окружающие ткани, но с наличием метастазов в околокишечных лимфатических узлах;
Стадия С2 – опухоль, пенетрирующая все слои кишечной стенки с наличием метастазов в лимфатических узлах, расположенных в области перевязанных питающих сосудов;
Стадия D – наличие отдаленных метастазов.
В нашей стране принята классификация, в основу которой положены одновременно размер опухоли, глубина ее прорастания в стенку кишки и степень метастазирования в лимфатические узлы. Согласно этой классификации с учетом критериев TNM выделяют четыре стадии рака:
Стадия О. Рак in situ Tis N0 МО.
Стадия I. Опухоль прорастает в подслизистый слой стенки кишки Т1 N0 МО. Опухоль прорастает в мышечную оболочку стенки кишки Т2 N0 МО.
Стадия II. Опухоль прорастает через мышечную и серозную оболочки стенки кишки ТЗ N0 МО и распространяется на ткани, окружающие кишку. Опухоль прорастает в другие органы Т4 N0 МО
Стадия III. Любая степень местного распространения опухоли с поражением лимфатических узлов N1 —от 1 до 3 лимфатических узлов, любое Т N1 МО N2 — 4 и более лимфатических узла, любое Т N2 МО N3 — поражение любого количества лимфатических узлов, любое Т N3 МО расположенных вдоль сосудистых стволов.
Стадия IV. Любая степень поражения кишечной стенки с или без метастазов. Любое N М1, в лимфатические узлы, при наличии отдаленных метастазов. Любое Т.
Г. И. Воробьев и соавт. (2001) указывают, что точно определить стадию заболевания не всегда можно даже с помощью интраоперационной ревизии и гистологического изучения удаленного препарата, поэтому даже самую радикальную операцию следует считать лишь условно радикальной. Кроме того, в отличие от других солидных опухолей, размеры первичного поражения толстой кишки оказывают небольшое влияние на прогноз. Более существенны для исхода заболевания три другие параметра: поперечное прорастание или распространение опухоли по слоям кишечной стенки; вовлечение регионарных лимфатических узлов; отдаленные метастазы, что выявить при клиническом обследовании крайне сложно [3].
Наиболее частыми осложнениями КРР является нарушение кишечной проходимости вследствие обструкции кишки вплоть до возникновения острой кишечной непроходимости при полной обтурации, кишечные кровотечения при изъязвлении или травмировании опухоли, перифокальный воспалительный процесс, перфорации кишечной стенки (в зоне опухоли или на расстоянии от нее – диастатические – из-за перерастяжения стенки проксимального участка кишки). При локализации опухоли в правой половине толстой кишки у больных часто возникает выраженная анемия из-за длительно продолжающихся скрытых кровотечений. Сами по себе осложнения КРР вне зависимости от стадии опухолевого процесса являются показаниями к срочным и экстренным операциям.
В настоящее время является общепризнанным фактом, что у больных раком ободочной кишки нет альтернативы хирургическим методам лечения. Лучевая и химиотерапия, лазерное воздействие являются лишь вспомогательными. Хирургическое лечение больных с КРР заключается в удалении сегмента кишки, содержащего опухоль, его брыжейки и какого-либо органа, непосредственно вовлеченного в опухолевый процесс. Частота послеоперационных осложнений и летальности после экстренно выполненных вмешательств достигает соответственно 60 и 20% и в несколько раз превышает соответствующие показатели после операций, которым предшествовала подготовка больных. После плановых вмешательств послеоперационные осложнения наблюдаются у 10–12% больных, а летальность составляет 2–4% [3, 10, 11, 30, 49].
Отдаленные показатели оперативного лечения больных с КРР – показатели 5-летней выживаемости – четко коррелируют со стадиями заболевания. Так, наилучшие результаты получены у больных, перенесших радикальные операции при стадии А по Dukes (5-летняя выживаемость составляет 80–70%). При стадии В 5-летняя выживаемость колеблется от 64 до 70%. У больных с поражением регионарных параколических лимфатических узлов 1-го порядка (стадия С1) 5-лeтняя выживаемость составляет около 35%, а при вовлечении лимфатических узлов 2 и 3-го порядка (стадия С2) – немногим более 15%. При наличии отдаленных метастазов (стадия D) 5-летняя выживаемость колеблется от 0 до 30%. Следует заметить, что в настоящее время и в этой стадии при резекции или удалении метастатически пораженных органов возможно добиться 5-летней выживаемости, особенно у пациентов с единичными отдаленными метастазами небольших размеров (пятилетняя выживаемость после резекции печени при метастазах КРР достигает 25–30%) [10, 11, 30]. Однако сочетанная с вмешательствами на толстой кишке резекция печени по поводу метастазов КРР доступна в России лишь крайне ограниченному числу лечебных учреждений.
К сожалению, в настоящее время онкологи и хирурги сталкиваются, в подавляющем большинстве, с III и IV стадиями КРР, чем и определяются общие весьма безутешительные результаты лечения больных с данной патологией. Данное обстоятельство связано с тем, что симптоматика КРР по целому ряду объективных и субъективных причин становится очевидной либо при развитии осложнений КРР, либо при уже генерализованном онкопроцессе. Выявляемость онкологических больных на ранних стадиях заболевания при профилактических осмотрах до 80-х годов XX века находилась в пределах 10% от впервые зарегистрированных больных. Сегодня этот показатель еще ниже и при КРР не превышает 1% [3, 4, 6]. Очевидно, что ключом к принципиальному решению проблемы КРР должна являться диагностика заболевания на ранних стадиях. Единственный достоверный диагностический тест КРР – визуализация и биопсия опухоли при колоноскопии – зачастую оказывается запоздалым, поскольку проводится уже при наличии клинически манифестированного КРР. Охватить же скрининговым колоноскопическим обследованием все население в возрасте старше 60 лет в нашей стране на сегодняшний день практически нереально.
В этой связи особую актуальность приобретает выделение групп риска по развитию КРР с целью, как минимум, углубленного динамического клинико-инструментального наблюдения за данной категорией пациентов. Практически все современные исследователи единодушны в том, что выявление, изучение и своевременное лечение облигатных или факультативных предраковых образований – главные и наиболее эффективные меры снижения заболеваемости и смертности от КРР. По определению к предраковым состояниям (или условиям) относят заболевания, при которых возникает рак (качественный критерий) с различной частотой (количественный критерий). Под предраковыми изменениями понимают морфологический субстрат, именуемый дисплазией, предшествующий развитию опухоли.
К предраковым заболеваниям толстой кишки относят (по мере значимости):
Полипы и полипоз
Семейные и несемейные синдромы:
- семейный аденоматоз (семейный диффузный полипоз)
- синдромы Гарднера, Тюрко
- ювенильный полипоз
- синдром Каудена (вариант ювенильного полипоза)
- полипоз Пейтца – Егерса
- наследственный синдром Кронхайта – Канада
Солитарные и множественные полипы
Заболевания неполипозного характера:
- неспецифический язвенный колит
- болезнь Крона
- дивертикулез ободочной кишки
Наследственный неполипозный колоректальный рак (семейный рак толстой кишки)
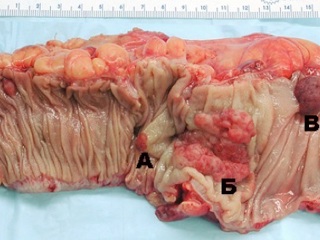
Поскольку целью настоящей работы является иллюстрация возможной профилактики развития КРР приемом НПВП, основанной, прежде всего, на предотвращении возникновения и снижении темпов роста колоректальных полипов, мы считаем необходимым подробное рассмотрение в качестве предракового состояния только полипов и полипозных синдромов. Под термином «полип» (макроскопически) следует понимать любое образование, выступающее над поверхностью слизистой оболочки и связанное с ней ножкой или широким основанием. При этом полип не обязательно является опухолью (воспалительный, лимфатический полипы), окончательно установить его природу можно только после микроскопии. По некоторым данным, полипы толстой кишки выявляются у 3, 5% практически здоровых людей, а у больных, наблюдающихся у колопроктологов по тому или иному поводу, они составляют 10, 4%. Если анализировать частоту полипов толстой кишки по результатам вскрытий, то при жизни эти опухоли не были обнаружены почти у 30% людей, умерших от разных причин [13, 14, 15, 22, 26, 39, 53, 54]. Приведенные данные не однозначны, небольшой процент «немых» полипов очевиден, и этот факт должен настораживать врачей, прежде всего, неонкологических и нехирургических специальностей.
По гистологическому строению все полипы делят на аденоматозные, гиперпластические, воспалительные, ювенильные и доброкачественные лимфатические. Говоря об аденоматозных полипах, следует отметить, что, в отличие от широкого собирательного понятия «полип», термин «аденома» подразумевает конкретное отражение гистологического строения, свидетельствующего о доброкачественной эпителиальной опухоли с признаками дисплазии различной степени выраженности. Аденомы делятся на три типа: тубулярные (железистые) полипы; тубулярно-ворсинчатые и ворсинчатые полипы. На ранних стадиях развития (до 2-3 мм) все аденомы имеют сходный внешний вид. Что касается тубулярных аденом, то более чем в 80% случаев их диаметр составляет менее 1 см. По мере увеличения размеров их поверхность остается ровной, но увеличиваются число долек и глубина борозд между ними, характерно также появление ножки. Тубулярная аденома состоит из ветвящихся и значительно извитых железистых трубочек, более длинных, чем в обычной слизистой.
Тубулярно-ворсинчатая аденома имеет более выраженную дольчатость и небольшие участки с очень мелкими дольками или ворсинками. В среднем их размеры больше тубулярных. Только 50% из них имеют диаметр до 1 см, остальные – более крупных размеров. Тубулярно-ворсинчатые аденомы составляют более 50% среди всех видов аденом. Ворсинчатые аденомы в подавляющем большинстве случаев имеют диаметр более 1 см, их поверхность покрыта тонкими, мягкими, легко травмирующимися ворсинками. По гистологическому строению эта доброкачественная эпителиальная опухоль состоит из тонких пальцевидных выростов соединительной ткани собственной пластинки слизистой оболочки, покрытых эпителием. Существуют убедительные доказательства развития рака в аденоматозном полипе – от дисплазии и атипии до очагового и инвазивного рака, причем атипия клеток нарастает с увеличением размеров и «ворсинчатости» аденомы. Не менее чем у 20% больных, оперированных по поводу рака толстой кишки, недалеко от опухоли обнаруживаются ворсинчатые полипы. Чаще всего малигнизация полипов происходит у их основания. Однако озлокачествление полипа может начаться и у его верхушки [1, 5, 12, 14, 22, 26].
В. В. Мартынюк (2000) указывает, что наличие аденом (аденоматозных полипов) ободочной кишки является одним из самых существенных факторов риска развития КРР. Несмотря на то обстоятельство, что в экспериментальных условиях показана возможность развития КРР на фоне неизмененной слизистой оболочки, подавляющее большинство как отечественных, так и зарубежных авторов полагают, что КРР в большинстве случаев развивается из аденом. Из этого следует, что выявление у пациентов с аденоматозных полипов позволяет относить их в группу повышенного риска по развитию КРР. Поэтому необходимость хирургического удаления аденоматозных полипов ободочной кишки с целью профилактики рака в настоящее время общепризнанна [10].
Знаменательно, что одиночные полипы, как правило, протекают без каких-либо специфических симптомов и выявляются чаще всего случайно при обследовании толстой кишки при независимом от наличия полипов появлении функциональных кишечных расстройств. Исследование частоты полипов толстой кишки у лиц, не предъявляющих жалоб, показывает, что при жизни полипы этой локализации не выявляются более чем у 30% пациентов. Отмечено, что с возрастом увеличивается число полипов, располагающихся в проксимальных отделах ободочной кишки. Кроме того, нередко имеет место сочетание полипов толстой кишки и карцином. В подавляющем большинстве случаев полипы толстой кишки протекают бессимптомно.
В пользу потенциальной возможности малигнизации аденом говорят следующие факты:
- пациенты, имеющие аденоматозные полипы в толстой кишке, подвержены более высокому риску развития КРР;
- аденомы и аденокарциномы ободочной кишки часто располагаются в одних и тех же ее сегментах;
- аденомы ободочной кишки встречаются в более молодом возрасте, чем аденокарциномы, и это позволяет предполагать, что аденомы предшествует развитию КРР;
- в странах, где рак ободочной кишки встречается часто, отмечается также и высокая частота аденоматозных полипов толстой кишки; и наоборот, низкая частота рака ободочной кишки во многих странах сочетается с низкой частотой аденом [6, 10, 12, 13, 30].
Доказано, что степень эпителиальной дисплазии в аденоматозном полипе прямо коррелирует с его размерами. Часто в аденоме находят фокусы аденокарциномы, которые располагаются исключительно в пределах аденоматозного полипа без перехода на окружающую слизистую кишки. Установлено, что малигнизация аденом нарастает с увеличением в них ворсинчатого компонента. Так, при тубулярных аденомах индекс малигнизации равен 5%, при тубулярно-ворсинчатых – 23%, а при ворсинчатых – 41%. Кроме того, риск злокачественной трансформации аденоматозного полипа тесно связан с его размерами. Зависимости частоты развития КРР от размеров и морфологического строения аденоматозных полипов иллюстрируется таблицей [1, 2, 10, 14, 15, 45, 53, 54].
Таблица. Зависимость частоты развития КРР от размеров и морфологии аденоматозных полипов.
Размер полипа | Морфологическое строение аденоматозного полипа | ||
Тубулярная аденома (%) | Тубулярно-ворсинчатая аденома (%) | Ворсинчатая аденома (%) | |
< 1 см | 1 | 4 | 10 |
1 – 2 см | 10 | 7 | 10 |
> 2 см | 35 | 46 | 53 |
Принято считать, что указанные морфологические формы аденом представляют собой последовательные этапы одного процесса, завершающегося образованием аденокарциномы толстой кишки. По данным В. Д. Федорова (1987) Переход тубулярных аденом в тубулярно-ворсинчатые и ворсинчатые происходит постепенно за определенный период, сотавляющий в среднем 3 – 4 года для каждой морфологической формы полипа. Для малигнизации также необходимо время, равное в среднем 2 – 3 годам [14]. Таким образом, трансформация тубулярной аденомы в рак может продолжаться от 10 до 15 лет.
Гиперпластические полипы. В ряде случаев обнаруживаются мелкие бляшковидные полипы с гладкой поверхностью, по цвету не отличающиеся от окружающей слизистой оболочки. Они бывают единичными и множественными. Их размеры редко превышают 5 мм и, как правило, не имеют ножки. По мнению большинства авторов, они не обладают неопластическим потенциалом. Эпителий на стенках крипт образует множественные мелкие складки, которые на поперечных срезах придают им характерный звездчатый вид. В глубоких отделах крипт обнаруживается гиперплазия эпителиальных клеток. Гиперпластические полипы могут трансформироваться в аденому, редко в рак [3, 13].
Воспалительные полипы возникают вследствие воспалительного процесса, обычно наблюдаются при язвенном колите или болезни Крона. В этих случаях их количество и размеры могут значительно варьировать. Воспалительные полипы представлены соединительной тканью, покрытой слизистой оболочкой с признаками хронического воспаления. Они могут возникать на фоне шигеллеза, амебиаза и шистосомоза. Довольно часто в биопсийном материале выявляются полиповидные утолщения из области операционных анастомозов толстой кишки. Обычно здесь обнаруживаются воспалительные полипы, состоящие из грануляционной ткани. При гистологическом исследовании они имеют довольно характерные черты: железы слизистой оболочки сохраняют свою удлиненную форму, иногда с кистозным расширением, в склерозированной строме определяется небольшое количество тонких мышечных пучков [3, 10, 13, 15].
Ювенильные полипы в основном встречаются у детей и юношей, отсюда и их название. Изредка они наблюдаются у взрослых. Чаще фиксируются одиночные ювенильные полипы, локализующиеся преимущественно в прямой кишке и значительно отличающиеся по своему строению от аденом. Одиночные ювенильные полипы имеют гладкую или дольчатую поверхность диаметром от 1 до 5 см, иногда они приобретают гроздевидную форму. Обычно они имеют длинную тонкую ножку. При микроскопическом исследовании в ювенильном полипе обнаруживаются кистозно-расширенные железы, устланные цилиндрическим эпителием без признаков дисплазии. В кистозных железах эпителий атрофирован, бокаловидные клетки не определяются. По мнению большинства исследователей, ювенильные полипы не малигнизируются [1, 3, 10, 11, 13, 53].
Доброкачественные лимфатические полипы – это образования, возникающие в области гиперплазированных лимфатических фолликулов. Чаще всего они выявляются у лиц молодого возраста. Обычно это образования размером 0, 1-0, 3 см в диаметре, при большом их количестве картина может напоминать диффузный полипоз (ДП). При гистологическом исследовании – это крупные лимфатические фолликулы с хорошо выраженным центром размножения. Слизистая оболочка над ними значительно атрофирована [1, 10].
Относительная частота встречаемости различных полипов может быть проиллюстрирована данными A. R. Chitale (2003), проанализировавшего результаты гистологических исследований за 30-летний период у 562 пациентов с одиночными и множественными толстокишечными полипами (см. табл. 1) [10, 11].
Таблица 1. Полипы толстой кишки: частота встречаемости по данным гистологического исследования (A. R. Chitale, 2003).
Морфологическая структура | n | % |
Аденоматозный полип | 260 | 46, 3 |
Виллезная аденома | 28 | 4, 9 |
Семейный полипоз | 6 | 1, 1 |
Ювенильные полипы | 203 | 36, 1 |
Гиперпластические полипы | 31 | 5, 5 |
Доброкачественные лимфатические полипы | 34 | 6, 1 |
Всего | 562 | 100 |
Полипоз. Множественный полипоз пищеварительного тракта – отдельная проблема, которая имеет ряд особенностей. Прежде всего, это достоверно более частая, чем при солитарных полипах, опасность ракового превращения множественных аденом толстой кишки. Почти у половины всех больных полипами толстой кишки эти новообразования имеют дискретный (несколько редких полипов вдали друг от друга) или множественный характер. Чем больше в кишке полипов, тем выше их злокачественный потенциал. Много споров вызывал и вызывает до сих пор вопрос — что считать множественными полипами и что диффузным полипозом толстой кишки. Есть мнение, что если обнаруживается до 100 полипов, то это множественный, а если больше 100 — диффузный полипоз. При диффузном полипозе (ДП) толстой кишки на фоне аденоматозного поражения часто обнаруживаются гиперпластические образования и/или ювенильные полипы. Большое число полипов и более старший возраст больных являются факторами риска КРР; при обнаружении более 1000 полипов риск рака выше в 2, 3 раза, при этом увеличивается частота синхронных раковых опухолей. Каждые 10 лет длительности болезни увеличивают риск рака в 2, 4 раза. Принято считать, что потенциал малигнизации при ДП приближается к 100%, поэтому таким больным показана ранняя (к моменту начальной диагностики болезни) колэктомия. Это заболевание поражает преимущественно молодых людей, часто имеет наследственный характер и тяжелое течение, которое нередко обусловлено появлением раковой опухоли. Наибольшее практическое значение из неоднородной группы ДП с эпителиальным характером полипов имеет наиболее распространенная аденоматозная форма, которая является облигатным предраком. В группе эпителиальных доброкачественных опухолей наряду с одиночными и множественными аденомами выделяется особая форма диффузного поражения слизистой оболочки толстой кишки железистыми полипами, называемая «аденоматозом» (аденоматозный полипоз) и имеющая наибольший потенциал в плане малигнизации [1, 2, 3, 7, 11, 14, 13, 23, 27]. Считается, что диагностировать диффузный полипоз толстой кишки, основываясь только на числе обнаруженных полипов, нельзя. Этот диагноз следует ставить при подтвержденном семейном и наследственном характере болезни, что при истинном диффузном полипозе имеет место в 100% случаев.
Полипоз (синдром) Пейтца-Егерса (Peutz-Jeghers) характеризуется сочетанием полипоза всех отделов пищеварительного тракта, меланиновой пигментацией слизистой оболочки и кожи, наследственным характером заболевания. Полипоз Пейтца-Егерса передается по закону доминантного наследования, однако иногда доминантный ген передает неполную информацию (слабая пенетрантность гена), и тогда один из признаков может отсутствовать. Так, встречаются больные без пигментации кожных покровов и слизистых оболочек. В настоящее время сложилось единое мнение о гамартомном характере полипов Пейтца-Егерса.
Синдром Кронкайт-Канада (Cronkhite-Canada) – полипоз пищеварительного тракта, сочетающийся с атрофией ногтей, пигментацией кожи, алопецией и гипопротеинемией.
Синдром Каудена (Cowden) – множественные гамартомы) – редкий семейный синдром, характеризующийся множественными гамартомами кожи, рта, пищеварительного тракта, щитовидной и молочной желез. Полипы состоят из различных тканей: гладких мышечных клеток, прослоек соединительной и жировой ткани, проникающих из подслизистой основы в тело полипа. Крипты слизистой оболочки сохраняют нормальное строение. При этом синдроме иногда наблюдается возникновение рака щитовидной или молочной железы.
Синдромы Гарднера (Gardner) , Тюрко (Turcot) , Олфилда (Olfild). Синдром Гарднера характеризуется сочетанием аденоматоза толстой кишки с опухолями мягких тканей или остеомами костей черепа. Наряду с синдромом Гарднера описывают сочетание полипоза с опухолью мозга (синдром Тюрко), опухолями надпочечника, щитовидной железы, кистами сальных желез (синдром Олфилда).
Прогноз при полипах толстой кишки, подразумевающий вероятность их трансформации в рак, как основной фактор неблагоприятных исходов, зависит от характера, количества и длительности существования полипов. В. Т. Ивашкин и соавт. (1999) считают, что при раннем выявлении аденоматозных полипов можно добиться хороших результатов в снижении смертности от КРР. При ранней полипэктомии частота КРР уменьшается на 70%, а смертность - на 100% [5, 11, 27, 28, 53]. Следовательно, успех в борьбе с КРР обусловлен двумя взаимосвязанными мерами: во-первых, ранним выявлением полипов и, во-вторых, их своевременным удалением. Однако следует помнить о том, что критерии малигнизации полипов (клинические, рентгенологические, эндоскопические, гистологические и, тем более, цитологические), особенно каждый в отдельности, далеко не всегда надежны. Ни большие размеры полипа, ни наличие широкой ножки не дают права уверенно ставить диагноз малигнизированного полипа. Большие ворсинчатые опухоли часто бывают доброкачественнымии, и, наоборот, иногда очень небольшой полип без узкой ножки оказывается малигнизнрованным или является начальной стадией солидного рака, саркомы или эндотелиомы. Г. И. Воробьев и соавт. (2001) указывает, что даже биопсия не имеет существенного значения в выборе тактики лечения полипов толстой кишки [3].
В этой связи практически во всех современных руководствах по колопроктологии в качестве метода лечения полипов толстой кишки указано только их хирургическое удаление. При единичных полипах методом выбора является их эндоскопическая электроэксцизия во время колоноскопии или ректороманоскопии. При множественных полипах и диффузном полипозе, когда эндоскопическое удаление полипов не представляется технически осуществимым, показано проведение резекционных оперативных вмешательств – от сегментарной резекции ободочной кишки до тотальной кол- и проктоколэктомии, то есть удаление отделов толстой кишки, несущих полипы. Несмотря на возникающие после обширных резекций толстой кишки выраженные функциональные нарушения, почти облигатно приводящие к социальной дезадаптации, необходимость операций такого объема, например, при семейном диффузном полипозе или синдроме Пейтца-Егерса не подвергается сомнению. Данная однозначность показаний к операции основана именно на установленной облигатной трансформации аденоматозных полипов в КРР.
Таким образом, ведение больных с полипами толстой кишки (то есть с предраковым состоянием) можно представить в виде трех моделей. Первая модель – «отставая на шаг». При данном варианте развития событий никаких активных действий со стороны медицинских работников не предпринимается (за исключением, конечно, пропаганды здорового образа жизни) вплоть до развития осложнений КРР или (и) генерализации опухолевого процесса. Автор позволит себе не вдаваться в рассуждения о давным-давно описанном некими оптимистами «синдроме малых признаков», поскольку полагает, что коллеги также склонны видеть в этих малых признаках проявление уже очень большой проблемы. Очевидно, что именно это «отставание на шаг» и определяет весьма грустное положение вещей в ситуации с исходами полипоза и КРР.
Вторая модель – «шагая в ногу». Она предполагает попытку своевременного выявления и ликвидации предраковых субстратов. При этом в результате скринингового обследования популяции выявляется выборка для динамического эндоскопического и морфологического наблюдения. Цель данной модели – определение групп риска по возникновению КРР, своевременное выявление и ликвидация потенциального предрака толстой кишки минимально инвазивными процедурами. Безусловно, по своей стратегии «шагать в ногу» лучше, чем «отставать на шаг». Однако с практической точки зрения скрининг даже с охватом только групп риска (возраст, национальность, хроническая патология толстой кишки, вредные привычки, ожирение) представляется трудно выполнимым. Раннее выявление возможно лишь посредством массового скрининга популяции с повышенным риском КРР даже при отсутствии каких-либо жалоб и симптомов со стороны желудочно-кишечного тракта. Много ли среди ваших пациентов тех, кто без видимой причины, многократно, с энтузиазмом подвергал себя колоноскопии?
Американские исследователи обоснованно указывают, что главными недостатками колоноскопии являются ее дискомфорт для обследуемого, дороговизна и возможные осложнения. При скрининговой колоноскопии совершенно закономерным является возрастание частоты перфораций кишечной стенки и постполипэктомического синдрома (не считая осложнений в результате премедикации). Основные рекомендации по скринингу включают начало скрининга в возрасте 50 лет, ежегодное тестирование кала на скрытую кровь и волоконную сигмоидоскопию каждые 3-5 лет у лиц со средним риском КРР. Во многих развитых странах внедряются различные скрининговые программы, которые постоянно пересматриваются, и ни одна из них пока что не может безоговорочно считаться приемлемой. Ранние генетические исследования являются многообещающими в качестве основы для разработки методов тестирования крови для членов семей с высоким риском КРР. Уже идентифицирован ген аденоматозного полипоза толстой кишки на длинном плече хромосомы 5 в локусе 5q 21 [6, 7, 11, 12, 22, 26], разработаны специфические ДНК-тесты, дополняющие клиническую оценку (эндоскопия, иридодиагностика), причем генетический диагноз семейного полипоза с использованием ДНК-маркеров возможен у 95% лиц при ожидаемой точности метода 98%. На хромосоме 2 предполагается наличие гена, ответственного за развитие кишечного рака, который имеет также значение при спорадических случаях рака толстой кишки. Идентифицирована микросателлитная цепь ДНК, экспрессируемая геном на хромосоме 2. Молекулярная техника уже позволяет выявить признаки врожденного риска КРР [58], однако генетически обусловленный рак составляет лишь 4-6% случаев КРР. Если удастся использовать молекулярные маркеры для выявления хотя бы 50% пациентов, имеющих низкий риск развития КРР, то все усилия по скринингу могли бы быть сосредоточены на оставшихся. Другим подходом может быть выявление в кале генных продуктов, указывающих на наличие ранней стадии рака или больших полипов [6, 7, 11, 16, 26, 30, 35, 50]. Однако, большинству исследователей адекватный скрининг посредством колоноскопии представляется наиболее близкой к идеалу программой, которая реально позволит уменьшить смертность от КРР. Таким образом, как показывает ежедневная клиническая практика, «шагая в ногу» мы постоянно немного отстаем. Как в известном примере, где заяц никогда не догонит черепаху.
Третья модель – «удар на опережение» - призвана принципиально изменить подход к КРР, а, точнее, вернуться к тем принципам, которые заложили еще праотцы медицины – принципам профилактики. Под профилактикой в данном случае подразумевается не только рекомендация дышать чистым воздухом и правильно питаться, избегая стрессов, а превентивное воздействие на механизмы канцерогенеза. Самое любопытное заключается в том, что уже сегодня мы имеем возможность проведения такой профилактик. Прежде всего – в отношении КРР.
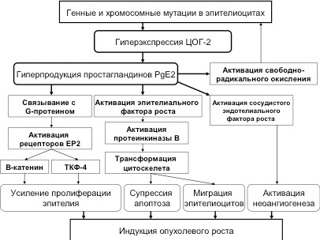
Современные концепции формирования аденом и аденокарцином толстой и прямой кишки основаны на нарушении процессов камбиальной пролиферации, апоптоза и межклеточных взаимодействий в толстокишечном эпителии, как основных факторов возникновения дис-, мета- и неоплазии. Молекулярно-генетические исследования последних десятилетий выявили тесную связь злокачественной прогрессии опухолей толстой кишки с накоплением соматических нарушений (мутаций) генов, контролирующих клеточный рост. В механизмах активации онкогенов и инактивации генов-супрессоров в опухолевых клетках в основном принимают участие генетические нарушения. Большинство генов, определяющих развитие КРР, прямо или опосредованно участвуют в регуляции клеточного цикла и (или) сигнальной трансдукции в отдельных клетках. На сегодняшний день доказано, что основным проявлением генных или хромосомных мутаций при развитии полипов и КРР является гиперэкспрессия фермента ЦОГ-2 в толстокишечном эпителии с гиперпродукцией простагландина PgE2. При этом негативные последствия локальной гиперэкспрессии ЦОГ-2 реализуются несколькими механизмами. Синтезирующиеся в избытке PgE2, взаимодействуя с G-протеином, связанным с мембранными рецепторами эпителиоцита (ЕР2), активирует клеточную пролиферацию через индукцию синтеза β-катенина и Т-клеточного фактора 4 (ТКФ-4). PgE2, кроме того, обладают способностью прямо или опосредованно активировать рецептор эпидермального фактора роста (РЭФР), что приводит к супрессии апоптоза, повреждению межклеточных контактов и миграции клеток. Непосредственная супрессия апоптоза происходит после активации РЭФР протеинкиназы В, приводящей к модификации актинина и структурной трансформации цитоскелета. Исследования in vitro доказали связь между активацией РЭФР, модификацией межклеточного матрикса и нарушениями клеточной адгезии. Наконец показана способность ЦОГ-2 к индукции неоангиогенеза в нескольких моделях, включая исследования опухолевых тканей, где была продемонстрирована корреляция между активностью ЦОГ-2, концентрацией в ткани сосудистого эндотелиального фактора роста и экспрессией генов, контролирующих ангиогенез [6, 7, 8, 29, 34, 37, 42, 47, 52].
Так, принимая во внимание тот факт, что активированный транскрипционный фактор NF-kB участвует в процессах пролиферации и апоптоза, продукции цитокинов и онкогенезе, Y. Liang-Liang et al. (2005) предприняли исследование, имеющее своей целью установить, активирован ли NF-kB конститутивно в ткани колоректальных опухолей человека, и если да, проанализировать ассоциацию экспрессии RelA и ЦОГ-2 в данных новообразованиях с пролиферацией опухолевых клеток. Экспрессия белков RelA, ЦОГ-2, Ki-67 была исследована с помощью методов иммуногистохимии на парафиновых срезах нормального эпителия, аденоматозных и аденокарциноматозных тканей. Для изучения ядерной транслокации RelA в тканях колоректальных опухолей применяли метод EMSA. Экспрессию мРНК ЦОГ-2 оценивали с использованием метода RT-PCR. В результате исследований авторы установили, что активация NF-kB была значительно выше в тканях колоректальной аденокарциномы, чем таковая в нормальном эпителии и аденоматозной ткани. Наблюдалось значительное повышение уровня пролиферации клеток и экспрессии ЦОГ-2 на уровне белка и мРНК при переходе от нормального фенотипа к опухолевому. На основании полученных данных Y. Liang-Liang et al. (2005) указывают на усиление NF-kB пролиферации путем увеличения экспрессии ЦОГ-2 и экспрессии RelA/NF-kB, что играет важную роль в патогенезе КРР [8].
Несколько иной механизм возникновения неоплазии при КРР объясняется кислородно-перекисной концепцией. Согласно ей, одна из ведущих ролей в механизме канцерогенеза принадлежит избыточным уровням свободнорадикальных неферментативных процессов пероксигенации (Б. Н. Лю и соавт. , 1991). В последние годы, однако, выяснилось, что в создании и поддержании в предопухолевых и опухолевых клетках состояния окислительного стресса как фактора канцерогенеза заметное участие принимают и ферментативные процессы. Это касается, прежде всего, липо- и циклооксигеназного путей метаболизма арахидоновой кислоты, которые в норме являются составными компонентами процесса активации пролиферации клетки и ингибирование которых препятствует развитию канцерогенеза. Действительно, оральное введение мышам соединения ТМК-688, сильного ингибитора 5-липооксигеназы (5-ЛОГ), подавляло образование опухоли кожи, индуцированной диметилбензантраценом и промотированной форболовым эфиром (Liang et al. , 1994). Другой ингибитор 5-ЛОГ А-79175 снижал число химически индуцированных опухолей легкого у мышей на 75 %, уменьшал возникновение тех же опухолей на 20 %, а их средний объем - на 64 %. Наиболее эффективной была комбинация А-79175 с ацетилсалициловой кислотой, которая снижала множественность неоплазм легкого на 87 %, а частоту их возникновения на 24 % (Rioux, Castonguay, 1998).
Особенно интересны представленные в литературе факты, указывающие на участие циклооксигеназного пути метаболизма арахидоновой кислоты в создании пероксигеназной ситуации. Так, у большинства больных КРР увеличена экспрессия ЦОГ-2. Ингибиторы ЦОГ-2 эффективно предотвращают образование колоректальных полипов и прогрессию их в рак (Pairet, 1997). Комбинация различных антиоксидантов с ингибиторами ЦОГ-2 аддитивно уменьшает экспрессию ЦОГ-2 в клетках КРР человека НСА-7; в опытах же in vitro эта комбинация приводит к регрессии опухоли (Chinery et al. , 1998). Исследование экспрессии ЦОГ-2 в образцах аденом, карцином, гиперпластических поражений и образцах нормальной слизистой, прилегающей к тканям опухолей, показало: в аденомах и карциномах экспрессия увеличена, по сравнению с нормальной тканью, на 89, 4% и 83% соответственно; в гиперпластических участках она тоже повышена, но несколько меньше, чем в опухолях. Hao et al. (1999) полагают, что в процессе спонтанного колоректального канцерогенеза гиперэкспрессия ЦОГ-2 происходит на ранних стадиях и может участвовать в опухолевой прогрессии. Сходная информация приведена и в других работах (Wilson et al. , 1998; Ratnasinghe et al. , 1999; Zimmermann et al. , 1999), где тоже изучали увеличенную экспрессию ЦОГ-2 в препаратах слизистой пищевода и желудка при раке пищевода. Результатом были подтверждение способности ЦОГ-2 быть медиатором воспаления и пролиферации, участником неопластической прогрессии. В повышенном количестве ЦОГ-2 синтезируется также в тканях рака поджелудочной железы, плоскоклеточного рака головы и шеи, где уровень ее мРНК увеличен соответственно в 60 и 150 раз по сравнению с нормальной прилегающей тканью (Tucker et al. , 1999) или тканью здоровых испытуемых (Chan et al. , 1999). Сверхэкспрессия ЦОГ-2 показана и в ткани аденокарциномы предстательной железы человека: в ее образцах от 12 больных уровень мРНК ЦОГ-2 был в 3, 4 раза выше, чем в гомологичной нормальной ткани (Gupta et al. , 2000) [7, 8, 9, 16, 34, 37, 42, 47, 52 ].
Свершению указанных процессов содействует, по-видимому, другой эффект ЦОГ-2: индукция ангиогенных факторов, необходимых для опухолевого роста. На клетках эндотелия и карциномы показано, что АСК и селективный ингибитор ЦОГ-2 целекоксиб подавляли образование ангиогенных факторов (Wunsch, 1998). В этом аспекте привлекательна и оригинальная модель канцерогенеза в молочной железе (Harris et al. , 1999). Она включает последовательную индукцию и стимулирующую регуляцию генов ЦОГ-2 незаменимыми жирными кислотами, содержащимися в пище. По этой модели, процесс канцерогенеза связан с биосинтезом простагландинов и образованием свободных радикалов О2 и N2, ответственных за инициацию онкогенеза. В частности, простагландин Е2 индуцирует биосинтез эстрогенов и экспрессию фактора роста эндотелия сосудов, которые соответственно поддерживают митогенез, стимулируют ангиогенез и метастазирование опухоли. В большинстве названных работ полагают, что ЦОГ-2 может быть мишенью для профилактики и терапии раковых заболеваний.
Таким образом, кислородно-перекисный механизм канцерогенеза определяют не только свободнорадикальные неферментативные процессы, зависимые в основном от уровней рО2 и активных форм кислорода, но и, в частности, ферментативные процессы перекисного окисления липидов [9].
Таким образом, гиперэкспрессия ЦОГ-2 и гиперпродукция PgE2 в клетках толстокишечного эпителия, обусловленная генными и хромосомными мутациями, приводит к усилению клеточной пролиферации, супрессии апоптоза, стимулирует неоангиогенез и усиливает процессы свободно-радикального окисления (см. рис. ). Данное объяснение злокачественной трансформации толстокишечных полипов является на сегодняшний день наиболее аргументированным и логичным. И, что самое главное, из данного объяснения следует реальная возможность целенаправленного воздействия на процесс канцерогенеза при КРР – медикаментозное ингибирование ЦОГ-2 НПВП.
В течение последних десятилетий был проведен ряд про- и ретроспективных исследований, позволивших установить, что прием НПВП может снижать риск развития КРР на 30 – 50%. Одним из первых было проведено проспективное исследование, продемонстрировавшее профилактический в отношении КРР эффект регулярного приема АСК у пациентов с повышенным риском развития злокачественных новообразований толстой кишки. Начиная с 1980 года, в Европе и США под наблюдением находились более 600000 взрослых пациентов, регулярно принимавших АСК в терапевтических (> 100 мг/сут) дозах 16 или более раз в месяц. Спустя шесть лет исследователи оценили частоту и причины летальных исходов в группе пациентов, принимавших АСК, и сравнили их с таковыми в сопоставимой группе пациентов, не принимавших АСК. Оказалось, что число летальных исходов от КРР в группе пациентов, принимавших АСК, было на 40% ниже, чем в группе пациентов, не принимавших АСК. S. Thun, ведущий исследователь в одном из клинических испытаний по изучению профилактического в отношении КРР приема АСК, уже в 2000 году заявил, что «из всего перечня химических агентов, исследованных на предмет профилактики КРР, аспирин и другие НПВП по своей эффективности близки к его вершине, особенно у пациентов, входящих в группу риска по КРР» [21, 31, 33, 41, 49].
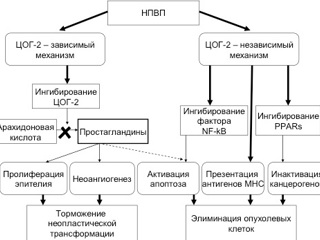
В ряде экспериментальных исследований было установлено, что кроме ингибирования синтеза PgE2, дополнительными защитными механизмами, препятствующими развитию КРР, являются прямой ЦОГ-2-независимый проапоптотический и антипролиферативный эффекты НПВП, которые обусловлены ингибированием фактора транскрипции NF-kB, а также ингибированием рецепторов, связанных с пролиферацией пероксисом (PPARs). НПВП влияют на «клеточный кругооборот» и, следовательно, на канцерогенез путем прямого и опосредованного ингибирования клеточной пролиферации и активности канцерогенов, которые могут ингибировать гены, активирующие апоптоз. Кроме того, подавляя активацию фактора транскрипции NF-kB, НПВП непосредственно ускоряют апоптоз. Возможно, НПВП способствуют элиминации опухолевых клеток путем регулирования презентации антигенов главного комплекса гистосовместимости (МНС) I, II и опосредованно тормозят активацию канцерогенов путем ингибирования PPARs [7, 34, 47, 52] (рис. ).
Неожиданное по своему замыслу и весьма демонстративное экспериментальное исследование, проведенное G. Orner et al. (2003), показало профилактический в отношении КРР эффект зеленого и белого чая, сулиндака и их комбинации. Объектом эксперимента являлись белые мыши линии АРСmin, имеющие в составе генома специфический ген аденоматозного полипоза толстой кишки (АРС). Данный ген аналогичен таковому у пациентов с семейным диффузным полипозом, что проявляется развитием у мышей линии АРСmin множественных аденоматозных полипов в толстой кишке с последующей облигатной их трансформацией в аденокарциному. В ходе исследования в течение 12 недель одной группе мышей в питьевую воду добавляли зеленый чай, другой – белый чай, третьей – сулиндак и четвертой группе мышей добавляли комбинацию белого чая и сулиндака. После вывода животных из эксперимента сопоставляли число случаев аденокарциномы толстой кишки в исследуемых группах и контрольной группе мышей АРСmin (во всех группах исследовались по 35 животных). В результате исследования было установлено, что в контрольной группе мышей АРСmin аденокарцинома развилась у 88, 6%, в группе, где применялся зеленый чай – у 48, 6%, в группе, где применялся белый чай – у 40, 0%, в группе, где применялся сулиндак – у 48, 6%, в группе, где применялась комбинация белого чая и сулиндака – у 22, 9%. Таким образом, прием НПВП сулиндака уменьшал риск трансформации аденоматозных полипов в аденокарциному на 40%, а комбинация сулиндака и белого чая – на 65, 7% [31].
Следует заметить, что включение в исследование, помимо сулиндака, зеленого и белого чая было отнюдь не случайным. G. Orner так аргументирует свой выбор. Целесообразность использования НПВП для профилактики КРР является фактом, доказанным и в ходе экспериментальных исследованиях на животных, и во время проведения клинических испытаний. Однако известные побочные эффекты традиционных НПВП, включая гастротоксичность, гепатотоксичность и нефротоксичность, выраженность которых прямо пропорциональна повышению дозы препарата и длительности терапии, являются серьезным фактором, ограничивающим возможность применения традиционных НПВП для профилактики КРР. Для длительного приема традиционных НПВП неизбежно требуется уменьшение дозы препарата, что, естественно, скажется на эффективности профилактики. Поэтому G. Orner предпринял попытку комбинации сулиндака, чей механизм протективного в отношении КРР известен, и зеленого и белого чая с гипотетической антиоксидантной активностью. Несмотря на полученные автором результаты экспериментального исследования, принимать всерьез возможность целенаправленной профилактики КРР зеленым и белым чаем в современной клинической практике весьма преждевременно.
Другое экспериментальное исследование продемонстрировало, что специфичные ингибиторы ЦОГ-2 подавляют неоангиогенез и рост опухоли у крыс с ксенотрансплантированными толстокишечными аденокарциномами. Sh. Tsugi et al. (2000), исследовав влияние экспрессии ЦОГ-1 и ЦОГ-2 и их ингибирование на прогрессию аденокарцином толстой кишки у серии крыс, отметили, что у крыс с пересаженной опухолью, экспрессирующей ЦОГ-2, пероральное лечение селективными ингибиторами ЦОГ-2, типа NS-398, или неспецифическими ингибиторами ЦОГ, подобных индометацину, происходило выраженное подавление нескольких мощных факторов ангиогенеза, таких как сосудистого эндотелиального фактора роста и базисного фактора роста фибробластов. Согласно сообщению, при ингибировании в зависимости от дозировки происходит уменьшение роста опухоли и неоангиогенеза, индуцируется апоптоз, подавляется репликация клеток ЦОГ-2-экспрессирующего ксенотрансплантата рака. В ЦОГ-2-неэкспрессирующих ксенотрансплантатах опухоли, неспецифические ингибиторы ЦОГ сократили прогрессию опухолевой ткани, по всей видимости, за счет ингибирования ЦОГ-1 в сосудистых эндотелиальных клетках; селективные ингибиторы ЦОГ-2 в данной модели видимого влияния на опухолевый рост не оказывали. По мнению авторов, результаты экспериментов свидетельствуют о том, что циклооксигеназы играют основную роль в прогрессии опухоли in vivo с помощью двух механизмов: ЦОГ-2 индуцирует апоптоз и регулирует продукцию факторов ангиогенеза в ЦОГ-2-экспрессирующих опухолях, а ЦОГ-1 ингибирует пролиферацию эндотелиальных клеток. Sh. Tsugi et al. указывают, что схемы ингибирования ЦОГ могут представлять новую стратегию для прекращения прогрессии толстокишечных аденокарцином. При этом, селективные ингибиторы ЦОГ-2 имеют потенциальное преимущество, так как клинически значимые результаты будут достигаться с меньшей токсичностью, чем при применении неселективных ЦОГ-ингибиторов [32, 38, 41, 42].
Таким образом, для профилактики КРР у лиц группы риска необходим НПВП, длительное применение которого в больших дозировках не вызывает развитие эрозивно-язвенного поражения ЖКТ, повреждения печени и почек. В этой связи внимание исследователей закономерно привлекли безопасные в отношении ЖКТ, обладающие минимальной гепато- и нефротоксичностью селективные ингибиторы ЦОГ-2 – коксибы.
Поскольку в целом ряде экспериментальных исследований было показано, что первый селективный ингибитор ЦОГ-2 целекоксиб подавляет рост и индуцирует апоптоз опухолевых клеток in vitro и in vivo у животных, в 1999 G. Steinbach et al. было предпринято первое клиническое исследование целекоксиба в качестве лекарственного средства для химиопрофилактики прогрессирования аденом толстой кишки у пациентов с семейным диффузным полипозом. По данным 6-месячного двойного слепого контролируемого испытания целекоксиба (100 г 2 раза в день и 400 мг 2 раза в день) в сравнении с плацебо у 83 больных семейным диффузным полипозом, у пациентов, получавших целекоксиб (400 мг 2 раза в день), отмечено достоверное снижение числа полипов (р = 0, 003) и уменьшение на 30, 7% размера полипов (р = 0, 001) по сравнению с группой пациентов, получавших плацебо. Целекоксиб в дозе 100 мг 2 раза в день оказался не эффективным для профилактики прогрессирования аденоматозных полипов. Примечательно, что частота побочных эффектов в сравниваемых группах больных не различалась. Эти данные свидетельствовали о возможности использования целекоксиба для лечения семейного диффузного полипоза и, соответственно, для профилактики развития у этих пациентов КРР [48].
В 2006 году в печати были представлены отчеты о трех исследованиях, посвященных применению селективных ингибиторов ЦОГ-2 целекоксиба и рофекоксиба у пациентов с аденоматозными полипами толстой кишки: АРС (Adenoma Prevention with Celecoxib) – M. Bertagnolli et al. , PreSAP (Prevention of Sporadic Adenomatous Polyps) – N. Arber et al. , APPROVe (Adenomatous Polyps Prevention on Vioxx) – J. Baron et al [18, 19, 20, 21, 25, 44] (см. табл. ). По своему дизайну все три исследования являлись двойными слепыми плацебо-контролируемыми. Перед началом исследования пациенты, имевшие в анамнезе единичные или множественные аденоматозные полипы толстой кишки, но не страдавшие семейным диффузным полипозом, подвергались колоноскопии. При этом все обнаруженные аденоматозные полипы подвергались электроэксцизии. Учитывая данные литературы, спустя три года у 40 – 60% этих пациентов следовало ожидать появления новых аденоматозных полипов, а у 10 – 20% - крупных аденоматозных полипов, имеющих тубулярно-виллезную и виллезную структуру, высокую степень дисплазии и являющихся облигатным предраком.
В исследование АРС были включены 2035 пациентов. Критериями включения являлись либо наличие крупных (> 6 мм в диаметре) аденом, либо их многочисленность. 685 пациентов в течении трех лет получали терапию целекоксиб в дозе 200 мг дважды в сутки, 671 пациент – целекоксиб в дозе 400 мг дважды в сутки, 679 пациентов получали плацебо. При повторных колоноскопиях, спустя 1 год (89% пациентов) и 3 года (75, 7% пациентов) от момента рандомизации, оценивали факт возникновения новых полипов. При анализе результатов исследования было установлено, что у 60, 7% пациентов, получавших плацебо, в течении 3 лет в толстой кишке сформировались новые аденоматозные полипы, что еще раз подтвердило тезис о практически неизбежном рецидивировании аденоматозных полипов в толстой кишке после их удаления. У пациентов, получавших целекоксиб в дозе 200 мг дважды в сутки, спустя 3 года аденоматозные полипы были выявлены у 43, 2% пациентов (относительный риск 0, 67; ДИ 95, 0, 59 – 0, 77; р < 0, 001), у пациентов, получавших целекоксиб в дозе 400 мг дважды в сутки, в те же сроки аденоматозные полипы были выявлены всего у 37, 5% (относительный риск 0, 55; ДИ 95, 0, 48 – 0, 64; р < 0, 001). Таким образом, применение целекоксиба в дозировках 400 и 800 мг в сутки позволило уменьшить число повторно возникших аденоматозных полипов на 17, 5% и на 23, 2% соответственно [20]. По сравнению с группой плацебо у больных, получавших целекоксиб, риск возникновения осложнений сердечно-сосудистых заболеваний был выше (ОР при дозе 200 мг — 2, 6; 400 мг — 3, 4). Авторы исследования отмечают, что, несмотря на эффективность целекоксиба в предотвращении аденом толстого кишечника, препарат не следует рутинно назначать в группе больных с сердечно-сосудистой патологией в фазе суб- и декомпенсации [21].
В исследовании PreSAP (107 исследовательских центра в 32 странах) был рандомизирован 1561 пациент, получавший плацебо или целекоксиб в дозе 400 мг в сутки однократно в соотношении 628: 933 соответственно. Аналогично предыдущему исследованию, спустя 1 год (88, 7% пациентов) и 3 года (79, 2% пациентов) от момента рандомизации, при контрольной колоноскопии оценивали факт возникновения новых полипов. Из 557 пациентов, получавших плацебо, и 840 пациентов, получавших целекоксиб, вновь возникшие аденоматозные полипы при контрольных колоноскопиях были выявлены у 264 и 270 пациентов соответственно. У пациентов, получавших целекоксиб в дозе 400 мг в сутки однократно, спустя 3 года аденоматозные полипы были выявлены у 33, 6% пациентов, у пациентов, получавших плацебо, в те же сроки аденоматозные полипы были выявлены у 49, 3% (относительный риск 0, 64; ДИ 95, 056 – 0, 75; р < 0, 001). В те же сроки в группе пациентов, получавших плацебо, крупные аденоматозные полипы были выявлены у 5, 3% пациентов, получавших целекоксиб, и у 10, 4% пациентов, получавших плацебо. На основании полученных результатов исследования было сделано заключение о том, что применение целекоксиба в дозе 400 мг в сутки однократно достоверно снижает частоту повторного возникновения аденоматозных полипов в толстой кишке в течение трех лет после полипэктомии. На основании результатов исследования и собственного клинического опыта ведущий исследователь в PreSAP, N. Arber, заявил, что «многие пациенты возвращаются к использованию целекоксиба вследствие его уникального профиля безопасности в отношении желудка и кишечника, это одна из основных причин, по которой врачи и пациенты выбирают целекоксиб. Традиционные НПВП, такие как наиболее популярные ибупрофен и напроксен, также могут работать в отношении профилактики колоректального рака, однако применяемые по данным показаниям в высоких дозах, они могут быть неприемлемыми для пациентов с высоким риском желудочно-кишечных осложнений. Высокая дозировка целекоксиба в данном исследовании не повлияла на безопасность пищеварительного тракта». Bernard Levin, еще один автор этого исследования, подчеркнул, что целекоксиб, без сомнений, эффективен и в уменьшении размеров, и в предупреждении развития аденом у пациентов с повышенным риском рака толстого кишечника. Он отметил также, что статистически достоверного повышения риска развития осложнений со стороны сердечно-сосудистой системы на фоне применения препарата выявлено не было [18].
В третьем исследовании АPPROVe была исследована эффективность профилактики аденоматозных полипов толстой кишки при применении селективного ингибитора ЦОГ-2 рофекоксиба. В исследовании приняли участие 2366 пациентов с аденоматозными полипами толстой кишки. Как и в предыдущих исследованиях, перед началом APPROVe всем пациентам производилась колоноскопия с удалением визуализированных полипов. 1158 пациентов получали рофекоксиб в дозе 25 мг в сутки однократно, 1218 пациентов получали плацебо. Результаты исследования во многом оказались сходными с результатами АРС и PreSAP: у пациентов, получавших рофекоксиб, спустя 3 года аденоматозные полипы были выявлены у 42, 8% пациентов, у пациентов, получавших плацебо, в те же сроки аденоматозные полипы были выявлены в 56, 5% случаев [19].
Комментируя результаты данных исследований, M. Bertagnolli обращает внимание на различную эффективность профилактического действия селективных ингибиторов ЦОГ-2 при оценке через 1 и 3 года от начала исследования. Учитывая тот факт, что морфологические изменения, приводящие к развитию аденокарциономы, прослеживаются в течение 10 – 15 лет, а максимальная эффективность селективных ингибиторов ЦОГ-2 наблюдается в первый год после начала терапии, нецелесообразно продолжать профилактическое введение данных препаратов весь данный период. Напротив, для предотвращения процессов метаплазии и инвазивного роста толстокишечных аденом имеет смысл профилактическое ведение селективных ингибиторов ЦОГ-2 относительно коротким курсом. Данное предположение подтверждается результатами исследования эффективности профилактического действия целекоксиба у пациентов с семейным диффузным полипозом, когда препарат применялся всего 6 месяцев. Назначение селективных ингибиторов ЦОГ-2 коротким курсом, по мнению M. Bertagnolli, с одной стороны, не увеличивает вероятность проявления побочных эффектов терапии данными препаратами, и, с другой – позволяет в полной мере проводить эффективную профилактику метаплазии и образования новых аденоматозных полипов толстой кишки [21].
В настоящее время изучение эффективности и безопасности применения целекоксиба для профилактики КРР продолжается в ходе трех многоцентровых рандомизированных исследований (III фаза клинических исследований): 1) Целекоксиб для профилактики колоректального рака у молодых пациентов с генетической предрасположенностью к семейному диффузному полипозу; 2) Целекоксиб в лечении пациентов с семейным диффузным полипозом; 3) Целекококсиб изолированно или в сочетании с эфлорнитином для профилактики клоректального рака у пациентов с семейным диффузным поолипозом [25, 44].
Таблица. Результаты эффективности профилактики формирования аденоматозных полипов толстой кишки при применении селективных ингибиторов ЦОГ-2 (по материалам исследований Adenoma Prevention with Celecoxib, Prevention of Sporadic Adenomatous Polyps, Adenomatous Polyps Prevention on Vioxx).
Исследование Препарат (доза) | Пациенты с вновь развившимися аденомами (спустя 1 год после рандомизации), % | р (сравнение с плацебо) | Пациенты с вновь развившимися аденомами (спустя 3 года после рандомизации), % | р (сравнение с плацебо) | Снижение числа случаев вновь развившихся аденом (на 1000 пациентов в год), % |
Исследование АРС | |||||
Плацебо | 44, 6 | 60, 7 | |||
Целекоксиб (200 мг х 2 р/сут) | 30, 3 | < 0, 001 | 43, 2 | < 0, 001 | 36, 3 |
Целекоксиб (400 мг х 2 р/сут) | 22, 8 | < 0, 001 | 37, 5 | < 0, 001 | 31, 3 |
Исследование PreSAP | |||||
Плацебо | 32, 5 | 49, 3 | |||
Целекоксиб (400 мг х 1 р/сут) | 20, 8 | < 0, 001 | 33, 6 | < 0, 001 | 17, 0 |
Исследование APPROVe | |||||
Плацебо | 40, 6 | 56, 5 | |||
Рофекоксиб (25 мг х 1 р/сут) | 26, 1 | < 0, 001 | 42, 8 | < 0, 001 | 17, 7 |
Таким образом, применение НПВП является патогенетически обоснованным методом профилактики возникновения аденоматозных полипов толстой кишки и, следовательно, методом профилактики КРР. Принимая во внимание необходимость многомесячного применения НПВП для достижения эффективной профилактики гипер-, дис- и неопластических процессов, следует учитывать неизбежный риск возникновения эрозивно-язвенного поражения ЖКТ, повреждения печени и почек, связанный с длительностью приема и высокими дозировками этих препаратов. В этой связи предпочтение, отдаваемое большинством исследователей профилактическому применению именно селективных ингибиторов ЦОГ-2 – коксибов, не оказывающих токсического воздействия на пищеварительный тракт даже при длительном применении в высоких дозах, представляется совершенно закономерным и не имеющим на сегодняшний день реальной альтернативы.
Список литературы.
- Аруин Л. И. , Капуллер Л. Л. , Исаков В. А. Морфологическая диагностика болезней желудка и кишечника. – М. , 1998. – С. 412-450.
- Владимирова А. А. и др. Характеристика полипов у пациентов со злокачественными новообразованиями толстой кишки // Актуальные вопросы колопроктологии. – Самара, 2003. – С. 201-202.
- Воробьев Г. И. Основы колопроктологии. Учебное пособие. М. , 2001, 414 с.
- Злокачественные новообразования в России в 1997 году (под ред. В. И. Чиссова), М. , 1997, 288 с.
- Ивашкин В. Т. Колоректальный рак // Российский журнал гастроэнтерологии, гепатологии, колопроктологии -1999. - №1. - С. 88-95.
- Ивашкин В. Т. , Минасян Г. А. Перспективы профилактики и раннего выявления колоректального рака. РМЖ, 1996 г, том 4, № 2.
- Имянитов Е. Н. Клинико-молекулярные аспекты колоректального рака: этиопатогенез, профилактика, индивидуализация лечения. Практическая онкология, 2005, № 2, с. 65 – 70.
- Лианг-Лианг Ю. , Хонг-Ганг Ю. б Жди-Пинг Ю. Роль NF-kB в регуляции экспрессии ЦОГ-2 и пролиферации клеток колоректальной карциномы человека. 2005. www. exp-oncology. com. ua/ru/archives/17/261. html.
- Лю Б. Н. , Исмаилов Б. И. Ферментативные пути метаболизма полиненасыщенных жирных кислот и канцерогенез. Материалы IV съезда онкологов Республики Казахстан. Алматы, 2001, с. 82-83.
- Мартынюк В. В. Рак ободочной кишки (заболеваемость, смертность, факторы риска, скрининг). Практическая онкология, 2000, № 1, с. 3 – 9.
- Просоленко К. А. , Жукова В. Б. Адекватная курация пациентов с толстокишечными полипами – эффективная профилактика колоректального рака. Здоров’я Украiни, 2006, 21/1.
- Ривкин В. Л. Толстокишечный канцерогенез // Клиническая геронтология. – 2003. – № 8. – С. 76-80.
- Ривкин В. Л. , Кирьянов И. В. , Никитин А. М. , ЛукинВ. В. Полипы и полипоз толстой кишки. – М.: ИД Медпрактика-М, 2005. – 152 с.
- Фёдоров В. Д. О лечебной тактике при полипах толстой кишки. Хирургия, 1987, №1, с. 82-88.
- Федоров В. Д. , Никитин А. М. Диффузный полипоз толстой кишки. М. , 1985, 114 с.
- Яицкий Н. А. , Васильев С. В. , Дубина М. В. Новые возможности молекулярных исследований в диагностике рака толстой кишки. Материалы VII Российской онкологической конференции. Москва, 2003..
- Anderson W. , Umar A. , Viner J. The role of cyclooxigenase-2 inhibitors in cancer prevention. // Cur Pharm Des, 2002; 8: 1035-62.
- Arber N, Eagle C, Spicak J. Celecoxib for the prevention of colorectal adenomatous polyps. // N Eng J Med, 2006; 355: 873-84.
- Baron J, Sandler R, Quan H. A randomized trial of rofecoxib for the prevention of colorectal adenomas. // Gastroenterology? 2006; 131: 1674-82.
- Bertagnolli M, Eagle C, Zauber A. Celecoxib for the prevention of sporadic colorectal adenomas. // N Eng J Med, 2006; 355: 873-84.
- Bertagnolli M. Chemoprevention of colorectal cancer with cyclooxigenase-2 inhibitors: two steps forward, one step back. // Lancet Oncol, 2007: 439-43.
- Bond J. H. Polyp Guideline: diagnosis, treatment, and surveillance for patients with colorectal polyps // Am. J. Gastroent. – 2000. – № 95 (11). – P. 3053-3063.
- Burke C, Arber N, Phillips RK, et al. Exisulind continues to prevent colonic adenoma formation in familial adenomatous polyposis (FAP) patients treated for 18 months. Program and abstracts of Digestive Disease Week 2000; May 21-24, 2000; San Diego, California. Abstract 3605.
- Burke C, Van Stolk R, Arber N, et al. Exisulind prevents adenoma formation in familial adenomatous polyposis (FAP). Program and abstracts of Digestive Disease Week 2000; May 21-24, 2000; San Diego, California. Abstract 3604.
- Celecoxib Significantly Reduces the Risk of Precancerous Colorectal Polyps. the NCI Cancer Bulletin, vol. 3/no. 34, Sept. 5, 2006.
- Clark S. K. Diagnosis and treatment of familial adenomatous polyposis // Dis. Colon. Rectum. – 2004. – № 47. – P. 985.
- DiSario JA, Foutch PG, Mai HD, et al. Prevalence and malignant potencial of colorectal polyps in asymptomatic average-risk men. Am J Gastroenterol 1991: 86: 941-5.
- Doniec J. M. et al. Endoscopy removal of large colorectal polyps // Dis. Colon. Rectum. – 2003. – № 46. – P. 340-348.
- Fearon E. R. , Vogelstein B. A. A genetic model for colorectal tumorigenesis // Cell. - 1990. - Vol. 61. P. 759-767.
- Fleshner DE, Goldberg SB, Browing TH, et al. Detection and surveillance of colorectal cancer. JAMA 1989: 261: 580-5.
- G. Orner. Chemoprevention of Colon Cancer. www. lpi. oregonstate. edu/fw04/cancer. html.
- Gately S. , Kerbel R. Therapeutic potential of selective cyclooxigenase-2 inhibitor in the management of tumor angiogenesis. // Prog Exp Tumor Res, 2003; 37: 179-92.
- Goel A, Chang DK, Ricciardiello L, Chauhan D, Boland RC. Aspirin increases the expression of DNA mismatch repair proteins in human colon cancer cells. Program and abstracts of Digestive Disease Week 2000; May 21-24, 2000; San Diego, California. Abstract 3602.
- Jackson LM, Bennett AJ, Watson S, Morrison T, Clarke P, Bell D, Hawkey CJ. Suppression by peroxisome proliferator activated receptoralpha ligand of intestinal polyp development in APCmin mice. Program and abstracts of Digestive Disease Week 2000; May 21-24, 2000; San Diego, California. Abstract 3606.
- Joslyn G, Carlson M, Thilveris A. Identification of deletion mutations and three new genes at the familial polyposis locus. Cell 2001: 66: 601-13.
- Kudo Sh. The role of magnifying colonoscopy in colonoscopic examination with an emphasize on depressed type lesion // Dis. Colon. Rectum. – 2004. – № 47. – P. 1034.
- Levin T. Colorectal screening: new opportunities. // Surg Oncol Clin N Am, 1999; 8: 673-91.
- Marnett L. , Kalgutkar A. Cyclooxigenase-2 inhibitors: discovery, selectivity, and the future. // Trends Pharmacol Sci, 1999; 20: 465-69.
- Muller A. D. , Sonnenberg A. Prevention of colorectal cancer by flexible endoscopy and polypectomy: A case-control study of 32, 702 veterans //Ann. Intern. Med. – 1995. – № 123. – Р. 904-910.
- Oshima M, Dinchuk J. Suppression of intestinal polyposis in Apc delta knockout mice by inhibition of cyclooxigenase-2. // Cell, 1996; 87: 803-09.
- Pai R. , Nakamura T. , Moon W. Prostaglandins promote colon cancer cell invasion; signaling by cross-talk between two distinct growth factor receptors. // FASEB J, 2003; 17: 1640-47.
- Pai R. , Sorgehan B, Szabo I. Prostaglandin E2 transactivates EGF receptor: a novel mechanism for promoting colon cancer growth. // Nat Med, 2002; 8: 289-93.
- Rex D. K. , Cutler C. S. et al. Colonoscopic miss rates of adenomas determined by back-to-back colonoscopies // Gastroenterology. – 1997. – № 112. – Р. 24-28.
- Rostom A. , Dube C. , Lewin G. Non-steroidal drugs and cyclooxigenase-2 inhibitors for primary prevention of colorectal cancer: a systemic review. // Ann. Int. Med. , 2007; 146: 376-89.
- Rubio C. A. , et al. Classification of Colorectal Polyps: Guidelines for the Endoscopist // Endoscopy. - 2002. P. 226-236.
- Saurin JC, Ligneau B, Lepretre J, Chavaillon A, Napolean B, Ponchin T, Chayvialle JA. Prospective evaluation of duodenal polyposis progression in familial adenomatus polyposis (FAP) patients, and genotype-phenome correlation. Program and abstracts of Digestive Disease Week 2000; May 21-24, 2000; San Diego, California. Abstract 3603.
- Sheng H. , Shao J. Modulation of apoptosis and Bcl-2 expression by prostaglandin E2 in human colon cancer cells. // Cancer Res, 1998; 58: 362-66.
- Steinbach G, Lynch P, Phillips R. The effect of celecoxib, a cyclooxigenase-2 inhibitor, in familial adenomatous polyposis. // N Eng J Med, 2000; 342: 1946-52.
- Strumer T. , Glynn R. J. , Lee I. -M. , et al. Aspirin use and colorectal cancer: post-trial follow-up data from the Physician's Health Study. Ann Intern Med1998;128: 713—20.
- Vasen HF, Wijnen JT, Nagengast FN, et al. Colonoscopic screening of carriers of mismatch repair gene mutations: Results from the Dutch HNPCC registry. Program and abstracts of Digestive Disease Week 2000; May 21-24, 2000; San Diego, California. Abstract 3601.
- Vinogradova Y. , Hippisley–Cox J. , Coupland C. , Logan R. F. Risk of Colorectal Cancer in Patients Prescribed Statins, Nonsteroidal Anti-Inflammatory Drugs, and Cyclooxygenase-2 Inhibitors: Nested Case-Control Study. Gastroenterology. August 2007;133: 393–402.
- Wang D. , DuBois R. Prostaglandins and cancer. // Gut 2006; 55: 115-22.
- Winawer S. J. , Zauber A. G. et al. Prevention of colorectal cancer by colonoscopic polypectomy // N. Engl. J. Med. – 1993. – № 329. – Р. 1977-1983.
- Wu K. , Titzer D. , Soetikno R. Use of a colonoscope instead os a sigmoidoscope to screen asymptomatic adults for colorectal cancer // Endosc. – 2003. –№ 58. – P. 720.
29 февраля 2016 г.
Ещё больше полезной информации на нашем Телеграм-канале