Приведены особенности метаболических изменений, нутритивной недостаточности и синдрома системного воспалительного ответа у пациентов с острым панкреатитом. Показана роль парентерального введения жировых эмульсий в коррекции данных нарушений и улучшения результатов системной терапии у пациентов с острым панкреатитом.
Пожалуй, ни одному из острых хирургических заболеваний не уделяется в последние десятилетия столь пристального внимания клиницистов, представителей параклинических служб, морфологов и даже организаторов здравоохранения, как острому панкреатиту. Несмотря на детальное изучение патологических процессов, присущих данной нозологической единице, выработку стандартизированных диагностических и лечебных подходов, основанных на применении новых технологических решений, как со стороны оперативной хирургии, так и в области фармакотерапии, приходится констатировать, что кардинального изменения результатов лечения больных острым панкреатитом в первом десятилетии нового века не произошло.
Тем не менее, позитивным опытом прошедших десятилетий явилось признание мультидисциплинарности проблемы и тенденция к поэтапному решению отдельных ее составляющих. Так, абсолютно осуществимыми для современной хирургической клиники стали прогнозирование течения патологического процесса с разделением всей массы больных острым панкреатитом на группы, сообразно тяжести заболевания, и связанное с этим выделение пациентов, исходно нуждающихся в проведении интенсивной терапии. Доступны в наше время эффективное медикаментозное ингибирование внешнесекреторной функции поджелудочной железы, проведение детоксикации при ферментной токсемии, хирургическая коррекция морфологических изменений на всех стадиях заболевания малоинвазивными оперативными вмешательствами, целенаправленные попытки профилактики и разрешения абдоминального компартмент-синдрома и, наконец, коррекция неизбежно наступающих при остром панкреатите метаболических нарушений. При этом именно в возможности целенаправленного контроля над системным воспалением и напрямую связанных с ним изменений нутритивного статуса все большее число исследователей видит реальную возможность решения проблемы острого панкреатита.
Для правильного понимания роли нутритивной поддержки при остром панкреатите, связанной не только c очевидной необходимостью компенсации энергозатрат и дефицита пластических субстанций, но и с возможностью контроля над процессами, определяющими тяжесть возникающих системных нарушений и перспективу развития синдрома полиорганной недостаточности, следует остановиться на основных составляющих патогенеза метаболических нарушений при данном заболевании.
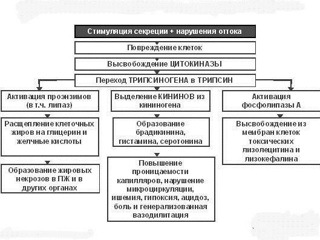
До настоящего времени вопрос о триггерных механизмах, реализующих алкогольный или билиарный факторы в процесс внутриклеточной активации панкреатических ферментов остается открытым. Тем не менее детально изучены в эксперименте и в ходе клинических наблюдений последствия интраацинарной активации проферментов трипсина, химотрипсина, липазы, проэластазы, карбопептидазы, панкреатической амилазы. С одной стороны это аутодигестивные деструктивные процессы, затрагивающие ацинарные, стромальные элементы железы с переходом на парапанкреатичекую клетчатку, а также, что не менее значимо, повреждение сосудистой стенки интрапанкреатических артерий и вен с резким увеличением их проницаемости для ферментных и биологически активных регуляторных субстанций, в колоссальном количестве образующихся в стадии острого повреждения панкреатической паренхимы.
Местные воспалительно-некротические процессы имеют своим следствием отек ткани железы, парапанкреатической клетчатки и рядом расположенных структур (в том числе и стенки двенадцатиперстной кишки), экстенсивная геморрагическая инфильтрация, некроз и секвестрирование большего или меньшего объема поджелудочной железы и парапанкреатических тканей, возникновение локальных жидкостных скоплений и, впоследствии, облигатное эндогенное инфицирование некротизированных тканей и жидкостных скоплений (locus minimus resistentis) с формированием панкреатических и парапанкреатических абсцессов и флегмон забрюшинной клетчатки.
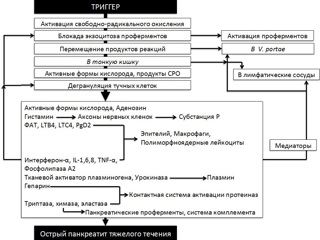
Вторым составляющим патогенеза острого панкреатита, существенно отличающим его от других воспалительных заболеваний органов пищеварения и, во многом определяющим тяжесть течения заболевания, является инициирование выраженного системного воспалительного ответа выходом в кровоток из паренхимы поджелудочной железы каскада биологически активных регуляторных медиаторов. Развитие синдрома системной воспалительной реакции (ССВР) при остром панкреатите связано с высвобождением из ацинарной ткани в системную циркуляцию за весьма ограниченный промежуток времени значительного количества провоспалительных медиаторов, таких как интерлейкины IL-1, IL-6, IL-8, фактор некроза опухолей (TNF-α) и фактор, активирующий тромбоциты. При этом активируется каскад системы комплемента, в плазме резко повышается концентрация продуктов свободно-радикального окисления, оксида азота, продуктов метаболизма арахидоновой кислоты – простагландина Е2 (PgE2), тромбоксана А2 (TxA2) и лейкотриена 4 (LT4). Согласно концепции Association of Physicians of Great Britain and Ireland (2012), рассматривающей влияние биологически активных субстанций на эволюцию патологических изменений при остром панкреатите, первая волна патологических реакций, обусловленных триггерным влиянием химических субстанций и повышением внутрипротокового давления, включает высвобождение из ацинарных клеток протеолитических зимогенов, амилазы и липазы вместе с ФАТ (фактором активации тромбоцитов) и ПСРО (продуктами свободно-радикального окисления). При этом ФАТ не является прямым активатором тучных клеток и способствует их дегрануляции опосредованно. В дальнейшем в поврежденной клетке индуцируется синтез хемокинов, цитокинов и стрессовых белков. Вследствие повышения проницаемости протоковой системы усиливается дегрануляция тучных клеток. Чрезмерная концентрация ПСРО и ФАТ поддерживает блок экзоцитоза и усиливает воспаление.
Указанные метаболиты и другие медиаторы прямо или опосредованно вызывают повреждение слизистой тонкой кишки, что, с одной стороны, имеет своим следствием нарушение барьерной функции кишечной стенки и возникновение феномена бактериальной транслокации, а, с другой стороны, в сочетании с нарушением моторики кишечной трубки (вследствие доминирующего влияния симпато-адреналовой системы, отека и компрессии висцеральных нервных сплетений, прямого токсического воздействия на ауэрбаровское и мейсснеровское сплетения), определяет нарушение абсорбционной способности кишки в отношении нутриентов. Повреждающее действие гидролаз, цитокинов и резорбированных в кровоток продуктов ацинарной деструкции не ограничивается только кишечной стенкой. Панкреатическая эластаза и а-химотрипсин приводят к деструкции альвеоло-капиллярной мембраны и эндотелия легочных капилляров ксантиноксидазой, что находит свое отражение в развитии РДСВ, а повышенный уровень фосфолипазы и свободных жирных кислот ассоциируется с повреждением сурфактанта и последующим формированием ателектазов и выраженной альвеолярной экссудацией. Аналогичные повреждения эндотелия и тканевых структур органов носят системный характер, что закономерно приводит к развитию гиперметаболического состояния с отрицательным энергетическим балансом. Многие исследователи указывают на наличие сходных метаболических нарушений у пациентов с тяжелым острым панкреатитом и у пациентов с сепсисом – гиперкинетический тип кровообращения, гиперметаболизм, гиперкатаболизм. Энергетические потребности у данных пациентов возрастают на 70 – 140%, протеолиз скелетной мускулатуры у пациентов с тяжелым панкреатитом может достигать 80% с ежедневной потерей до 40 г азота. Несмотря на некую универсальность процессов катаболизма при ССВР любой этиологии, метаболизм основных нутриентов при остром панкреатите имеет ряд особенностей, что необходимо учитывать при планировании нутритивной поддержки.
Вследствие прогрессивно возрастающих энергетических потребностей закономерным явлением при остром панкреатите является мобилизация глюкозы из депо гликогена и активизация процессов глюконеогенеза с основным субстратом в виде белка поперечно-полосатой скелетной мускулатуры. Несмотря на то, что глюкоза является основным донатором энергии, даже гипотетическая возможность бесконечного увеличения ее количества в плазме не в состоянии лишить всех проблем энергообеспечения. Максимальное количество глюкозы, способное быть окисленным в организме составляет 4 мг/кг в минуту, при этом избыточное количество глюкозы утилизируется в ходе липогенеза, также требующего энергозатрат. Стойкая гипергликемия сама по себе отнюдь не является безобидным явлением и определяет, как минимум, возникновение гиперкапнии. В свою очередь гипергликемия при остром панкреатите тяжелого течения, имеющая место у 40 – 90% пациентов, часто носит неконтролируемый характер вследствие гибели инсулярного аппарата островков Лангергханса и является одним из предикторов неблагоприятного прогноза. При этом даже введение экзогенного инсулина в больших дозах, необходимое не менее чем у 80% пациентов с тяжелым панкреатитом, способно лишь частично корригировать высокий уровень гликемии.
Процессы протеолиза, сопровождающиеся повышением концентрации в плазме аминокислот, являются закономерной составляющей катаболизма и затрагивают прежде всего белок поперечно-полосатой скелетной мускулатуры. При этом прогрессирование потери азота (нарастающий отрицательный азотистый баланс) является крайне неблагоприятным прогностическим критерием при тяжелом панкреатите. Поэтому наиважнейшей задачей нутритивной поддержки при остром панкреатите является минимизация белковых потерь и компенсация азотистого баланса. Любопытным фактом, косвенно относящимся к изменению белкового обмена при остром панкреатите, является установленное ингибирующее влияние парентерального введения растворов аминокислот на внешнесекреторную активность поджелудочной железы.
Одной из характерных черт нарушений липидного обмена при остром панкреатите является стойкое состояние гиперлипидемии. До сих пор неясно является ли она этиологическим фактором заболевания, или же это следствие повреждения ткани железы и гиперлипаземии. Известно, что у людей со стойкой гиперлипидемией, доходящей до 80 – 110 ммоль/л риск возникновения острого панкреатита принципиально выше, чем в популяции и бедная жирами диета способна предупредить возникновение данного заболевания. С другой стороны возникновение острого панкреатита приводит к нарастанию в динамике концентрации триглицеридов, холестерола и свободных жирных кислот. При разрешении воспалительно-деструктивного процесса разрешается и гиперлипидемия. Сниженный клиренс липидов показан не менее чем у 15% пациентов с острым панкреатитом. Эмпирически сформулирован порочный круг, включающий повреждение ацинарных элементов ткани железы, находящихся в состоянии острого воспаления, циркулирующими в плазме липидами при одновременном повышении концентрации циркулирующих липидов неконтролируемым высвобождением панкреатических липаз. При этом гидролизированные из хиломикронов триглицериды оказывают непосредственное токсическое действие на капиллярные мембраны, резко увеличивая сосудистую проницаемость и приводя к дальнейшему повреждению паренхимы поджелудочной железы.
В ходе биологических экспериментов было установлено, что выраженное экзогенное повышение уровня триглицеридов приводит к увеличению концентрации свободных жирных кислот в плазме подопытных животных и появлению распространенных тромбозов микроциркуляторного русла с признаками ишемического повреждения ткани поджелудочной железы. В то же время в большинстве исследований, посвященных изучению жировых эмульсий, значимого увеличения внешнесекреторной функции поджелудочной железы при внутривенной инфузии эмульсий липидов установлено не было, как до настоящего времени нет достоверных доказательств прямой индукции острого панкреатита собственно гиперлипидемией. При введении жировых эмульсий в пищеварительную трубку было отмечено, что величина панкреатической секреции коррелирует с анатомическим уровнем введения липидов (местом установки энтерального зонда). Так, максимальная стимуляция панкреатической секреции отмечалась при введении липидов в двенадцатиперстную кишку, тогда как при их введении за дуодено-еюнальный переход, в проксимальный отдел тонкой кишки, значимого увеличения секреции не отмечалось. Впрочем данная корреляция имеет место по отношению не только к липидам, но и к вводимым в просвет пищеварительной трубки поли- и олигопептидам. Данный факт объясняется наиболее сильной стимуляцией панкреатической секреции локальными холинэргическими рефлексами и холецистокинином, продуцируемым в дуоденальной слизистой, при попадании в просвет двенадцатиперстной кишки химуса. Холецистокинин секретируется также и в тонкой кишке, однако продукция данного регуляторного пептида прогрессивно уменьшается от проксимальных отделов кишки к дистальным. В ходе многочисленных экспериментальных и клинических исследований было установлено, что внутривенная инфузия жировых эмульсий (5%, 10% или 20%) в моноварианте или в сочетании с инфузией аминокислот и углеводов не оказывает достоверного влияния на экзокринную активность поджелудочной железы.
Помимо нарушения метаболизма макронутриентов, важным элементом метаболических нарушений при остром панкреатите являются нарушения, касающиеся и микронутриентов. Гипокальциемия, степень которой коррелирует с тяжестью заболевания, наблюдается у 40 - 60% пациентов. Причины снижения концентрации кальция плазмы многочисленны и включают омыление кальцием свободных жирных кислот, гипоальбуминемию, снижение концентрации магния, повышение продукции кальцитонина при одновременном снижении выработки паратгормона. Кроме снижения уровня кальция в плазме при остром панкреатите также доказано наличие дефицита цинка, тиамина и фолиевой кислоты.
Таким образом метаболические нарушения при остром панкреатите затрагивают все виды обмена, имея гиперметаболический и гиперкатаболический характер. При этом повышенный катаболизм протеинов и процессы глюконеогенеза не контролируются введением экзогенной глюкозы, возрастают энергозатраты, но, в то же время, вследствие имеющейся инсулинорезистентности уменьшается значение глюкозы и возрастает роль окисления жирных кислот в качестве основного энергетического субстрата. Обладая качественно сходными чертами, количественно выраженность метаболических изменений существенно варьирует от субклинического течения с самокомпенсацией нутритивной недостаточности при остром панкреатите легкого и среднетяжелого течения (менее 3 балов по критериям Ranson) до состояния выраженной мальдигестии при тяжелом панкреатите. В последнем случае выраженная реакция системного воспаления с последующим присоединением инфекционного фактора (инфицированный панкреонекроз) придает субстратному метаболизму при остром панкреатите сходство с метаболическими изменениями при тяжелой травме и сепсисе.
Цели нутритивной поддержки при остром панкреатите логично вытекают из необходимости коррекции имеющихся метаболических нарушений: обеспечение пациента энергетическими субстанциями, снижение интенсивности протеолиза, контроль интенсивности ССВР и профилактика возникновения полиорганной недостаточности, предупреждение дистрофии энтероцитов и возникновения синдрома энтеральной недостаточности с бактериальной транслокацией. При этом нутритивная поддержка не должна способствовать изменению функционального состояния поджелудочной железы, а именно – не усиливать синтез и экскрецию панкреатических ферментов.
Основной предмет дискуссии при обсуждении нутритивной поддержки пациентов с острым панкреатитом в течении последних десятилетий состоит в приоритетах энтерального или парентерального способов доставки нутриентов. До настоящего времени по данному вопросу существуют две диаметрально противоположные точки зрения. Согласно одной из них с целью обеспечения максимального функционального покоя поджелудочной железе и в условиях нарушенной моторной функции пищеварительной трубки нутритивная поддержка должна осуществляться только парентерально.
Другая точка зрения, основанная на необходимости профилактики энтеральной недостаточности, указывает на приоритет энтерального питания. Сторонники данной точки зрения подчеркивают, что введение питательных смесей в просвет пищеварительной трубки имеет ряд неоспоримых преимуществ: сохраняется функциональная и морфологическая интактность энтероцитов и, следовательно, барьерная и иммуномодулирующая (снижение выброса спланхнических цитокинов) функция кишечника, энтеральное введение олигопептидов обеспечивает более эффективный синтез белка в организме пациента, исключаются опасности гипералиментации и катетер-ассоциированных инфекций, являющиеся осложнениями парентерального питания, наконец, энтеральные смеси значительно дешевле ингредиентов парентерального питания. Для исключения стимулирующего влияния питательных смесей на экзокринную секрецию поджелудочной железы энтеральная поддержка должна осуществляться через назо-энтеральный зонд, установленный за дуодено-еюнальный переход в проксимальный отдел тонкой кишки. Не оспаривая вышеприведенные доводы, сторонники парентерального питания указывают, что единственным, но весьма существенным обстоятельством, делающим невозможным энтеральное питание, является нарушение моторики пищеварительной трубки – закономерное следствие острого панкреатита. Атония желудка и замедление перистальтики кишечника при тяжелом панкреатите, инфицированном панкреонекрозе, в послеоперационном периоде прогрессируют до стойкого пареза пищеварительной трубки с возникновением динамической кишечной непроходимости. Очевидно, что проведение энтерального питания в таких условиях просто невозможно. Срок разрешения пареза весьма вариабелен и поэтому рекомендации о необходимости и целесообразности решения всех проблем нутритивной поддержки исключительно энтеральным введением смесей в реальной клинической практике неприемлемы. Естественно, что оптимальный вариант нутритивной поддержки заключается в сочетании парентерального и энтерального путей. При сохраненной перистальтике и возможности введения адекватного потребностям объема питательной смеси предпочтительной является энтеральная нутритивная поддержка. В остальных случаях необходимо либо дополнительное, либо полное парентеральное питание.
Рассматривая количественные параметры питания, большинство авторов сходятся во мнении о необходимости проведения изо- или гипокалорической нутритивной поддержки пациентам с острым панкреатитом средней тяжести и пациентам с тяжелым панкреатитом в дебюте заболевания, до развития септических осложнений (табл. 1). При этом энергоемкость вводимых субстанций должна составлять не менее 15 – 20 ккал/кг в сутки. Констатация наличия у пациента инфицированного панкреонекроза и сепсиса диктует необходимость увеличения калоража вводимых нутриентов до 30 – 35 ккал/кг в сутки. При этом не менее 20 ккал/кг в сутки должны являться небелковыми. Безусловно, в каждом конкретном случае необходим индивидуальный расчет величины основного обмена. Однако, непрямая калориметрия, достаточно точно отражая индивидуальные энергопотребности, пока остается весьма малораспространенным в отечественной клинике методом. Оценка величины основного обмена с помощью измененной формулы Харриса-Бенедикта, хотя и встречает массу нареканий вследствие своей неточности, пока остается наиболее простым и широко используемым в клинике методом.
Рекомендуемые дозировки нутриентов при остром панкреатите тяжелого течения (по Meier R. , Sobotka L. , 2003).
Субстрат | Количество |
Энергия | 25 – 35 ккал/кг/сут |
Углеводы | 4 – 6 г/кг/сут |
Белок или аминокислоты | 1, 2 – 2, 0 г/кг/сут |
Липиды | До 2, 0/кг/сут |
Количество белка, вводимого в составе питательных смесей, для пациентов с острым панкреатитом средней тяжести и для пациентов с тяжелым панкреатитом в ранней фазе заболевания должно составлять 1, 2 – 1, 5 г/кг в сутки. Увеличение количества вводимого белка более 1, 5 г/кг в сутки должно быть мотивировано только состоянием выраженного отрицательного азотистого баланса, поскольку увеличение выработки мочевины на фоне возросшей доставки белка для организма не является безразличным. Следует заметить, что белок, являясь не только субстратом пластического обмена, но и энергоносителем, должен включаться в общий расчет калорий, что существенно снижает риск гипералиментации. В то же время для утилизации аминокислот необходимы дополнительные небелковые калории, то есть растворы аминокислот необходимо вводить с дополнительным источником калорий (липиды или углеводы): одновременное длительное введение всех нутриентов, последовательное введение и болюсное введение. Наиболее благоприятным является режим одновременного введения всех нутриентов.
Необходимое введение моносахаридов как с целью компенсации энергозатрат, так и с протеин-сберегающей целью лимитировано сниженной толерантностью к глюкозе, очевидно коррелирующей с тяжестью заболевания. Введение глюкозы при остром панкреатите всегда должно сопровождаться введением эквивалентной дозы инсулина, однако количество последнего не должно превышать 4 - 6 единиц в час. При этом целевой уровень гликемии при остром панкреатите составляет менее 10 ммоль/л. Рекомендуемое количество вводимой глюкозы – 3 – 6 г/кг в сутки, однако дозировка вводимой глюкозы должна подбираться индивидуально, исходя из степени толерантности к ней того или иного пациента. Использование только глюкозы в качестве субстрата для компенсации энергозатрат, как известно, чревато целым рядом крайне негативных побочных эффектов, что наглядно продемонстрировали десятилетия так называемого «американского» подхода к парентеральной нутритивной поддержке.
В этой связи и, что более существенно, вследствие исходно имеющихся сложных нарушений углеводного обмена при остром панкреатите особенно актуальным при определении приоритетов в выборе донаторов энергии является смещение акцентов от моносахаридов к липидам. Однако в настоящее время жировые эмульсии при остром панкреатите рассматриваются отнюдь не только как на энергетический субстрат. Помимо эффективного донатора энергии липидам при остром панкреатите отводится роль компонента Immunonutrition, используемого для стабилизации ССВР при тяжелом панкреатите и инфицированном панкреонекрозе, минимизации системных тканевых повреждений и предупреждения развития синдрома полиорганной недостаточности. Кроме того, в некоторых исследованиях продемонстрирована возможность использования жировых эмульсий для инактивации циркулирующей в плазме панкреатической липазы и уменьшения распространенности жировых некрозов.
Согласно рекомендациям ESPEN (2009) жировые эмульсии могут и должны быть использованы при остром панкреатите в дозировке 0, 8 – 1, 5 г/кг в сутки (максимально – до 2 г/кг в сутки), что обеспечивает до 60% суточной потребности пациента в энергии. Очевидно, что использование липидов с одной стороны исключает необходимость использования больших доз глюкозы и уменьшает риск возникновения гипергликемических осложнений, с другой стороны, способствует снижению интенсивности процессов протеолиза и глюконеогенеза. При этом фактором, лимитирующим возможность использования жировых эмульсий считается уровень триглицеридемии, превышающий 12 ммоль/л в течение 72 часов. Как было указано выше гипотетически предполагается возможность первичного индуцирующего действия триглицеридов на развитие острого повреждения панкреатической паренхимы. Однако также следует повторить и то, что на сегодняшний день доподлинно неизвестно, чем является гипертриглицеридемия и гиперхиломикронемия при остром панкреатите – причиной или следствием; при тенденции к разрешению воспалительного процесса в поджелудочной железе и при отсутствии экзогенного введения липидов уровень триглицеридемии самостоятельно нормализуется в пределах 48 – 72 часов.
Для правильной оценки возможностей применения жировых эмульсий у пациентов с острым панкреатитом следует коротко остановится на отличительных особенностях данных препаратов, применяемых в современной клинике (табл. 2).
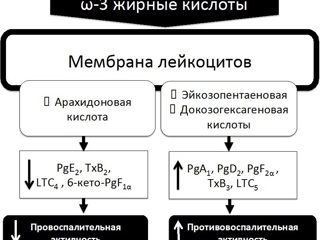
Несмотря на то, что жировые эмульсии для парентерального питания содержат большое число биологически активных компонентов, главной по значимости (как и по количеству) их составной частью являются триглицериды с жирными кислотами. При этом именно входящие в состав жировых эмульсий жирные кислоты определяют в целом как биологические свойства данной нутритивной субстанции, так и целесообразность ее использования у тех или иных хирургических пациентов. Жирные кислоты играют ключевую роль в детерминации структурного единства и пластичности клеточных мембран и, кроме того, являются субстратом для синтеза целого ряда универсальных биологических месседжеров - медиаторов. Известно, что жирные кислоты регулируют уровень экспрессии различных генов, непосредственно осуществляют или модулируют клеточные взаимодействия в таких процессах как апоптоз, воспаление, реакции клеточного звена иммунной системы. В свою очередь свойства и различная биологическая активность жирных кислот являются отражением их химической структуры, а именно: длины углеродной цепи (длинно-, средне- и короткоцепочечные), степени насыщенности (число двойных связей) и локализации двойных связей в молекуле (считается от метилированного углерода углеводной цепи). Так, например, длинноцепочечные полиненасыщенные жирные кислоты c различным положением одной из двойных связей (ω-6 или ω-3), такие как арахидоновая кислота (20: 4ω-6) или эйкозопентаеновая кислота (20: 5ω-3) и докозогексагеновая кислота (22: 6ω-3) являются исходными субстратами для синтеза провоспалительных или противовоспалительных медиаторов соответственно.
Первые опыты применения жировых эмульсий в качестве компонента парентерального питания в хирургической клинике, относятся 1960-е годам. В течение весьма короткого временного промежутка жировые эмульсии, производимые из соевого (Intralipid), реже – хлопкового масла (впоследствии эти препараты получили название «жировых эмульсий I поколения»), продемонстрировали бесспорный позитивный эффект данного варианта нутритивной поддержки, а именно: эффективное неуглеводное энергообеспечение пациентов при отсутствии нежелательных эффектов, связанных с введением высококонцентрованных растворов глюкозы. Более того, жировые эмульсии нивелировали дефицит незаменимых жирных кислот и жирорастворимых витаминов Е и К.
Однако в работах, датированных уже 1970-80-ми годами, появились аргументированные утверждения о том, что применение жировых эмульсии из соевого и хлопкового масла обусловливало развитие целого ряда значимых иммунодепрессивных эффектов, прежде всего – снижение миграционной и фагоцитарной активности гранулоцитов – и в свою очередь объясняло достоверный рост количества послеоперационных гнойно-септических осложнений. В 1997 году было принято решение европейского (ESPEN) и американского (ASPEN) экспертного советов по нутритивной поддержке не рекомендовать применение жировых эмульсий из соевого масла, содержащих ω-6 жирные кислоты, как минимум, в отделениях интенсивной терапии.
Классификация жировых эмульсий.
Поколение | Субстрат | Структура | Препараты |
I | Соевое масло Хлопковое масло | Длинноцепочечные триглицериды (LCT) | Intralipid Lipovenos Liposin |
II | Кокосовое масло Оливковое масло | Среднецепочечные (MCT) / Длинноцепочечные (LCT) триглицериды «физическая» смесь MCT/LCT «химическая» смесь MCT/LCT | Lipofundin MCT/LCT Medialipid Structolipid |
III | Рыбий жир + II | ω-3 жирные кислоты + Среднецепочечные (MCT) / Длинноцепочечные (LCT) | Omegaven Lipoplus SMOFlipid |
Опыт применения жировых эмульсий I поколения продемонстрировал те негативные качества, которые зачастую нивелировали закономерно ожидаемые позитивные эффекты от липидов как части парентеральной нутритивной поддержки у хирургических больных. Побочные эффекты жировых эмульсий I поколения первоначально связывались непосредственно с субстратом их производства – маслом сои и хлопка, содержащих только ω-6 полиненасыщенные длинноцепочечные жирные кислоты. Поэтому последующие попытки минимизации нежелательных эффектов применения жировых эмульсий были основаны на использовании в качестве субстратов масла кокоса, оливы, а впоследствии – рыбьего жира.
В 1984 году в клинической практике появились жировые эмульсии II поколения – физическая смесь триглицеридов с длинноцепочечными (LCT) из масла сои и среднецепочечными (МСТ) жирными кислотами из масла кокоса в соотношении 1: 1. Представители данного поколения жировых эмульсий, например – Lipofundin MCT/LCT, до настоящего времени с успехом используются в клинической практике. Разновидностью жировых эмульсий II поколения являются так называемые структурированные жировые эмульсии с эквимолярным соотношением LCT и МСТ и уменьшенным количеством октаеновой кислоты.
Дальнейшие попытки уменьшения доли ω-6 жирных кислот привели к появлению жировых эмульсий, 80% состава которых приходится на олеиновую кислоту (20: 3 ω-9), получаемую из оливкового масла. Несмотря на снижение иммуносупрессивного эффекта ω-6 жирных кислот, чрезмерное количество олеиновой кислоты в жировой эмульсии теоретически способно вызывать дефицит незаменимых жирных кислот, что нашло свое практическое подтверждение в клинике.
Появление жировых эмульсий III поколения датируется 1991 годом, когда впервые для парентерального питания стали доступны эмульсии, включавшие в качестве компонента ω-3 жирные кислоты, получаемые из рыбьего жира и продемонстрировавшие в эксперименте и в клинике свое противовоспалительное и иммуномодулирующее действие, востребованное у весьма значительной части хирургических больных. Примером данного типа жировых эмульсий является препарат Lipoplus, имеющий в своем составе 50% MCT-триглицеридов из масла кокоса, 40% ω-6 LCT-триглицеридов из масла сои и 10% ω-3 LCT-триглицеридов из рыбьего жира.
В отличие от провоспалительного эффекта ω-6-полиненасыщенных жирных кислот для ω-3-полиненасыщенных жирных кислот – эйкозопентаеновой и декозогексагеновой, содержащихся в рыбьем жире, P. Singer (2008) и C. Serhan (2008) экспериментально было подтверждено выраженное противовоспалительное действие. Противовоспалительный эффект ω-3 жирных кислот определяется возможностью интеграции в фосфолипиды клеточных мембран c конкурентным снижением интенсивности метаболизма арахидоновой кислоты. При этом эйкозопентаеновая и декозогексагеновая кислоты становятся превалирующими субстратами для липооксигеназы, трансформируясь в эйкозаноиды с принципиально меньшей провоспалительной активностью. Действительно, у хирургических пациентов, получающих в рамках парентерального питания жировые эмульсии, в которых соевое масло частично замещено на рыбий жир (в соотношении 3: 1), синтез лейкотриенов смещен от провоспалительных LTB4 (синтезируемых из арахидоновой кислоты) к не обладающим провоспалительным эффектом LTB5 (синтезируемых из эйкозопентаеновой кислоты). Следствием этого является достоверное снижение концентрации медиаторов воспаления IL-6 и TNF-α. У пациентов с абдоминальным сепсисом концентрация IL-1β, IL-6, IL-8 и TNF-α, высвобождаемых из мононуклеарных лейкоцитов, по данным K. Mayer (2003) была достоверно выше при инфузии жировых эмульсий из соевого масла по сравнению со снижением концентрации указанных медиаторов более чем на 30% при инфузии жировых эмульсий с ω-3-жирными кислотами. Жировые эмульсии из оливкового масла в отношении их влияния на системное воспаление до настоящего времени изучены недостаточно.
Известно, что терапевтический эффект при энтеральном назначении ω-3 жирных кислот наступает медленно, что делает такой путь введения неприменимым при острых заболеваниях. При использовании капсул с рыбьим жиром биодоступность молекул ω-3 жирных кислот ограничена, поскольку они попадают в системный кровоток только после прохождения кишечного барьера, организации в везикулы в виде триглицеридов и попадания в печень. В ходе данных трансформаций теряются свободные ω-3 жирные кислоты из-за процесса ремоделирования липидов. Следствием этого является ограниченная доступность свободных жирных кислот для интеграции в цитолемму как лейкоцитов, так и эндотелия сосудов и, соответственно, лимитирование их противовоспалительных эффектов. В отличие от этого, подчеркивают F. Grimminger et al. (2008), при внутривенной инфузии жировой эмульсии путь ремоделирования липидов в печени и кишечнике шунтируется, большое количество синтетических липидов активирует эндотелиальные липопротеинлипазы и вызывает перемещение этих ферментов из связанного с клеткой состояния в сосудистое русло. В результате резкого повышения концентрации свободных ω-3 жирных кислот в плазме становится возможным их свободное потребление клетками, рост концентрации в цитолемме и увеличение продукции метаболитов эйкозопентаеновой и докозогексагеновой кислот.
Закономерным представляется вопрос о сравнительных рисках возникновения гипертриглицеридемии при использовании LCT (Intralipid и т. п. ) или MCT/LCT (Lipofundin и т. п. ) жировых эмульсий. Несмотря на то, что достоверные данные в отношении прямого строго сравнения отсутствуют, мы вправе считать жировые эмульсии с MCT-жирными кислотами менее опасными в плане возникновении гипертриглицеридемии в связи с их принципиально более быстрой утилизацией тканями. К слову, данные (пусть даже в виде гипотетических предположений) о возможном повреждающем действии экзогенных липидов относились к временному периоду, когда в клинической практике использовались исключительно LCT-жировые эмульсии (I поколение). Средством, позволяющим достоверно уменьшить опасность критического повышения уровня триглицеридов и хиломикронов плазмы является одновременное применение MCT/LCT-жировых эмульсий c растворами углеводов. В этой связи особо привлекательным выглядит парентеральное питание с использованием систем «три в одном» (Nutriflex lipid и т. п. ). При этом поступление небелковых калорий, необходимых для утилизации экзогенных аминокислот, обеспечивается сбалансированным сочетанием углеводов и липидов, одновременно минимизируются риски как гипергликемии, так и гипертриглицеридемии.
Технология «все в одном» была впервые разработана С. Solasson с соавторами еще в 1974 году. Использование двух- и трехкомпонентных мешков для парентерального питания, где уже подобраны необходимые количества и метаболически верные соотношения аминокислот, глюкозы, липидов и электролитов показало целый ряд принципиальных преимуществ перед использованием изолированной инфузии макронутриентов: высокая технологичность, удобство и простота применения, одновременное и безопасное введение всех необходимых нутриентов; оптимально сбалансированный состав макронутриентов; снижение риска инфекционных осложнений; возможность добавлять необходимые микронутриенты (витамины/микроэлементы). При использовании технологии «все в одном» врачу не нужно специально рассчитывать соотношение вводимых аминокислот и энергии, соотношение глюкозы и жиров. Именно данное обстоятельство сделало парентеральное питание для пациентов хирургических отделений не «теоретически возможным», а практически осуществимым.
В настоящее время реализация программы нутритивной поддержки «все в одном» принципиально возможна в двух вариантах: системы «два в одном», содержащие раствор аминокислот с электролитами и раствор глюкозы, и системы «три в одном», содержащие раствор аминокислот с электролитами, раствор глюкозы и жировую эмульсию. В российской клинической практике используются трехкомпонентные системы для парентерального питания Kabiven, Oliclinomel, SMOFKabiven, Nutriflex lipid. В то время как Kabiven и Oliclinomel содержат в своем составе LCT-жировые эмульсии I поколения, Nutriflex lipid и SMOFKabiven включают в себя MCT/LCT-жировую эмульсию II поколения. В случае Nutriflex lipid – это Lipofundin MCT/LCT. Помимо этого Nutriflex lipid имеет уникальный физиологический баланс белков, небелковых калорий, жидкости, имеет наиболее полный аминокислотный состав для удовлетворения потребностей в белке, содержит глутаминовую кислоту, сбалансированное содержание глюкозы предупреждает развитие гипергликемии, содержит цинк для активации процесса заживления ран, удовлетворяет основную потребность в электролитах. Описанные свойства Nutriflex lipid предоставляют врачу возможность относительно простого в техническом отношении и в то же время адекватного по количеству и качеству доставляемых питательных субстратов решения проблемы нутритивной поддержки. Разнообразие предлагаемых решений по концентрации и объему трехкомпонентных контейнеров, таких как Nutriflex 40/80 lipid, Nutriflex 48/150 lipid и Nutriflex 70/180 lipid объемом 1250, 1875 и 2500 мл, позволяет удовлетворить потребности практически всех пациентов в самых различных клинических ситуациях, поскольку, как показывает клиническая практика, не менее 80% пациентов могут быть обеспечены парентеральным питанием с помощью систем «все в одном».
Необходимость предпочтения именно MCT/LCT жировых эмульсий при остром панкреатите иллюстрируются исследованиями, посвященными лечению пациентов с РДСВ, в том числе являющимся осложнением тяжелого панкреатита. При прямом сравнении LCT и MCT/LCT жировых эмульсий доказано позитивное влияние именно MCT/LCT жировых эмульсий на легочную гемодинамику и газообмен в легких при достоверном увеличении доставки и потребления кислорода. Тем не менее, необходимо принимать во внимание то обстоятельство, что сам по себе факт выраженной гипоксемии (PaO2 < 50 mmHg) является противопоказанием к инфузии любых липидов вследствие потери в данных условиях интермедиаторов цикла Кребса с невозможностью окисления жирных кислот в митохондриях. Еще одним доводом в пользу использования MCT/LCT жировых эмульсий при тяжелом панкреатите является доказанное отсутствие у них иммуносупрессивного и провоспалительного эффекта, как известно, весьма характерного для LCT жировых эмульсий.
В качестве примера использования MCT/LCT жировых эмульсий при остром панкреатите тяжелого течения приведем пример расчета необходимого суточного объема инфузии жировых эмульсий Lipofundin 10%, Lipofundin 20% и трехкомпонентной системы Nutriflex lipid 40/80 для пациента массой 80 кг:
80 кг х 1, 5 г/кг/сут липидов (потребность в энергии - 25 ккал/кг/сут) = 120 г липидов в сутки (2000 ккал/сут),
что соответствует 1200 мл Lipofundin 10% (1226 ккал), или 600 мл Lipofundin 20% (1145 ккал), или 2400 мл Nutriflex lipid 40/80 (2292 ккал).
Учитывая, что экзогенные липиды являются субстратом для действия липазы и колипазы, логично предположить целесообразность их применения при остром панкреатите, в том числе и с целью нивелирования возникающей при деструкции панкреатической паренхимы гиперлипаземии. В данном случае липиды жировых эмульсий играют роль «псевдомишеней», предотвращая формирование стеатонекрозов в тканях. В. К. Гостищев и соавт. (1983-98) показали, что жировые эмульсии подавляют избыточную липаземию при остром панкреатите в фазу эндогенной интоксикации и способствуют при прочих равных условиях снижению распространенности некротических процессов в ткани поджелудочной железы и в парапанкреатической клетчатке.
Совершенно закономерным в контексте обсуждения иммунных нарушений при остром панкреатите будет интерес к использованию при данном заболевании жировых эмульсий, содержащих в своем составе ω-3 полиненасыщенные жирные кислоты (Lipoplus и т. п. ). Первые опыты применения ω-3 жирных кислот в качестве компонента энтерального питания при остром панкреатите продемонстрировали как минимум троекратное снижение летальности и двукратное уменьшение длительности госпитализации по сравнению с применением липидов, содержащих ω-6 жирные кислоты. Помимо этого было продемонстрировано достоверное снижение частоты пневмонии, синдрома полиорганной недостаточности и уменьшение длительности нахождения пациентов в отделении интенсивной терапии при питании смесями, содержащими ω-3 жирные кислоты. Учитывая относительно невысокую биодоступность ω-3 жирных кислот при энтеральном введении, закономерно предполагать их принципиально большую эффективность в отношении иммуномодуляции при парентеральном применении. И действительно исследования, посвященные применению жировых эмульсий, содержащих ω-3 жирные кислоты, показали достоверное снижение в плазме пациентов провоспалительных медиаторов (IL-6, IL-8. TNF-α, CRP), что имело своим естественным следствием снижение выраженности ССВР. Наиболее иллюстративно в плане эффективности клинического применения жировых эмульсий, содержащих ω-3 жирные кислоты, оказалось исследование J. Wang (2008), при котором сопоставлялись две группы пациентов, получавших в составе парентерального питания жировые эмульсии, содержащие соответственно ω-3 или ω-6 жирные кислоты (см. табл. 3).
Влияние качества нутритивной поддержки на течение острого панкреатита (J. Wang, 2008).
ω-6 жирные кислоты n=20 | ω-3 жирные кислоты n=20 | |
ССВР | 9/20 | 4/20 |
РДСВ | 5/20 | 4/20 |
Инфицированный панкреонекроз | 5/20 | 3/20 |
Почечная недостаточность | 2/20 | 1/20 |
Пребывание в ОРИТ | 26+3, 4 | 18+2, 3 |
Длительность госпитализации | 70, 5+9, 1 | 65, 2+7, 3 |
Из приведенных данных следует, что целенаправленная иммунонутритивная терапия применением жировых эмульсий с ω-3 жирными кислотами способна купировать ССВР и его проявления, что имеет принципиальное значение при лечении больных в I фазу острого панкреатита, а также снизить интенсивность процессов эндогенного инфицирования при уже сформированных очагах панкреонекроза.
В качестве примера использования ω-3 жировых эмульсий при остром панкреатите тяжелого течения приведем пример расчета необходимого суточного объема инфузии жировых эмульсий Lipoplus 20%, для пациента массой 80 кг.
80 кг х 1, 5 г/кг/сут липидов (потребность в энергии - 25 ккал/кг/сут) = 120 г липидов в сутки (2000 ккал/сут), что соответствует 600 мл Lipoplus 20% (1146 ккал).
Жировые эмульсии, применяемые в качестве компонента парентеральной нутритивной поддержки у пациентов с острым панкреатитом, являют собой значительно большее, чем просто эффективный источник энергии. Они оказывают целый ряд биологических эффектов, которые могут рассматриваться как положительные, так и отрицательные в зависимости от конкретной категории пациентов. Большинство доступных в настоящее время жировых эмульсий обеспечивают пациента достаточным количеством ω-6 незаменимых жирных кислот. Несмотря на всю привлекательность идеи контроля ССВР при остром панкреатите введением «чистых» ω-3 жирных кислот, последние могут быть использованы только либо в качестве фармакологического препарата для реализации концепции Immunonutrition, либо как составная часть многокомпонентных жировых эмульсий (в связи c реально возможным возникновением дефицита незаменимых жирных кислот при введении только ω-3 жирных кислот). С другой стороны, как было указано выше, современные рекомендации по использованию жировых эмульсий у пациентов считают невозможным изолированное применение жировых эмульсий I поколения, произведенных только из соевого масла и содержащих исключительно LCT-жирные кислоты. При этом линолевая и α-линоленовая кислоты в жировых эмульсиях должны быть частично замещены МСТ-жирными кислотами, мононенасыщенными жирными кислотами кокосового масла (II поколение), а также эйкозопентаеновой и докозогексагеновой кислотами рыбьего жира (III поколение).
Особенности метаболических нарушений при остром панкреатите и неизбежное развитие ССВР при тяжелом его течении с одной стороны, а также теоретически обоснованная и доказанная возможность контроля этих системных изменений парентеральным введением некоторых типов жировых эмульсий – с другой, позволяют считать, что применение таких препаратов как Lipofundin MCT/LCT и Lipoplus способно повысить эффективность системной терапии у пациентов с острым панкреатитом и тем самым улучшить результаты лечения.
4 марта 2016 г.
Ещё больше полезной информации на нашем Телеграм-канале