Почти двухсотлетняя история использования в клинической практике нестероидных противовоспалительных препаратов (НПВП) является ярким примером научного поиска, в котором переплетаются, дополняя друг друга, эмпирический подход, основанный на блестящих по своей проницательности клинических наблюдениях, изучение фармакодинамики препаратов, базирующееся на исследованиях патогенеза местной и системной воспалительной реакции, и, наконец, целенаправленная разработка лекарственных средств с a priori заданной эффективностью и безопасностью. Примечательно, что именно поиски максимально безопасного препарата во многом и определяли ход научных разработок, поскольку при длительном приеме НПВП необходимость безопасной терапии является главной причиной предпочтения одних препаратов другим. Интересен и тот факт, что само раскрытие патогенетических механизмов возникновения побочных эффектов повлекло за собой целый ряд научных открытий, значительно изменивших наши представления как, собственно, о молекулярных основах лечебного действия НПВП, так и о некоторых функциональных особенностях пищеварительного тракта. Наконец два научных открытия, тесно связанных с исследованиями механизма действия НПВП и во многом объясняющие их токсические эффекты, отмечены присуждением их авторам Нобелевской премии в области физиологии и медицины. Данные обстоятельства делают необходимым и возможным изложение именно в исторической ретроспективе этапов становления существующей в настоящее время и представляющей непосредственный интерес в контексте настоящей монографии концепции токсических эффектов НПВП в отношении пищеварительного тракта.
Справедливости ради следует заметить, что история НПВП может исчисляться не двумя, а тремя столетиями, с того момента, когда в 1757 г. священник A. Stone из графства Оксфордшир, заинтересовавшись чрезвычайной горечью коры ивы, сходной по вкусу с изготовляемой из коры хинного дерева хиной – редким и дорогим средством для лечения малярийной лихорадки, начал клинические наблюдения за применением ивовой коры при лихорадочных состояниях. В 1829 г. французскому фармацевту I. Lerue удалось получить из коры ивы кристаллическое вещество, которое он назвал салицином (это название происходит от латинского названия ивы – «salix»). В 1838–1839 гг. итальянский ученый R. Piria расщепил салицин, показав, что это соединение является гликозидом, и, окислив ароматический фрагмент, получил вещество, которое назвал салициловой кислотой. По другим данным в 1828 немецкий химик Buchner из коры ивы выделил вещество, которое и назвал салицин. В 1835 г. немецкий химик К. Lewig получил из салицина кислоту, которую назвал салициловой. Вскоре обнаружилось, что салициловая кислота содержится в некоторых других растениях: почках тополя, маслинах, даже в апельсинах, вишне и сливе, но особенно много ее в таволге, которую и назвали Spirea salicifolia - cпирея салициловолистная.
Сначала салицин получали промышленным путем из очищенной ивовой коры, однако уже в 1874 г. в Дрездене была основана первая большая фабрика по производству синтетических салицилатов из фенола, диоксида углерода и натрия. В 1888 г. на фирме Bayer, занимавшейся до этого только производством анилиновых красителей, был создан отдел фармацевтики, основной задачей которого являлось производство салициловой кислоты в промышленных масштабах. Несмотря на то, что дешевизна салициловой кислоты позволяла надеяться на повсеместное ее применение, лимитирующим фактором широко использования салициловой кислоты в медицинской практике явились выраженные побочные эффекты терапии со стороны пищеварительного тракта: диспепсия, характерный для поражения гастродуоденальной зоны болевой синдром и даже желудочно-кишечные кровотечения.
К концу XIX века в литературе имелось уже достаточное количество упоминаний о гастротоксическом действии салициловой кислоты. В изданной в России в 1896 году Реальной энциклопедии медицинских наук при изложении фармакотерапии салицилатами подробно описывались побочные эффекты данных препаратов – диспепсия и гастралгия. Их появление связывалось в большей степени с местным раздражающим эффектом салицилатов, однако в то же время указывалось, что, «по мнению некоторых авторов,.. изменения в желудке могут представлять картину более глубоких анатомических нарушений». Было указано, что прием салицилатов может приводить к развитию желудочного кровотечения.
Знаменательно, что именно гастротоксичность салициловой кислоты в отношении пищеварительного тракта и явилась причиной, которая привела к созданию препарата, обладавшего принципиально меньшим токсическим потенциалом – ацетилсалициловой кислоты. F. Hoffman, сотрудник компании Bayer, впервые применил в клинической практике и обосновал необходимость промышленного производства ацетилсалициловой кислоты, показав ее принципиально меньшую токсичность в отношении пищеварительного тракта по сравнению с салицилатом. В 1899 г. компанией Bayer началось производство препарата под названием «аспирин» в качестве анальгезирующего, жаропонижающего и противовоспалительного средства. Бренд «аспирин» явился производным от «а» («acetyl» - ацетил) и «spirin» (произошедшее от латинского названия лабазника вязолистного (Spiraea ulmaria) – растения, содержащего большие количества салициловой кислоты). По другой версии название лекарству дали в честь святого Аспиринуса – покровителя всех страдающих головной болью.
Как считает подавляюще большинство современных исследователей, именно чрезвычайно широкое повсеместное использование АСК породило проблему НПВП–индуцированной гастропатии в ее нынешнем популяционном масштабе, которое в начале 90–х годов прошлого века расценивалась некоторыми исследователями, как настоящая эпидемия. Еще в 30–е годы было доказано, что АСК может вызывать повреждение слизистой желудка с формированием эрозий. Douthwait A. , Lintoff J. в 1938 г. представили в Lancet эндоскопическую картину «аспириновых» эрозий слизистой желудка. В руководстве по клинической фармакологии D. Laurens & P. Benitt (1991) указывается, что «если бы в настоящее время пришлось вводить ацетилсалициловую кислоту, маловероятно, что кто-либо из ответственных лиц набрался смелости разрешить ее продажу населению». Поскольку опыт применения АСК показал высокую потребность в анальгетических и противовоспалительных препаратах, во второй половине XX века фармакологическая промышленность разработала и внедрила в клиническую практику огромное количество различных классов НПВП, различающихся по эффективности, переносимости и удобству применения. Среди них можно выделить появившийся в 50–е годы индометацин – препарат, обладающий, по всей видимости, наиболее мощным противовоспалительным действием среди всех НПВП, но вызывающий значительное число нежелательных эффектов.
Несмотря на то, что основным вектором разработок новых НПВП вплоть до 80-х годов XX столетия являлось создание лекарственного средства, максимально эффективного в отношении локальной или системной воспалительной реакции, в научной литературе накапливалось все больше сообщений о токсическом действии данных препаратов на пищеварительный тракт. Эмпирическая констатация токсического влияния некоторых НПВП послужила поводом к изъятию из клинической практики оксифенбутазона, амидопирина, пипрофена, фенилбутазона и метамизола натрия. Именно эмпирическая констатация токсических эффектов НПВП, а не понимание механизма развития побочных эффектов данных лекарственных средств, очевидно, явилась и является той причиной, по которой вплоть до настоящего времени нежелательные реакции терапии НПВП описываются как некие артефакты. Тем не менее, начатая еще в 30-е годы прошлого века целая череда научных открытий позволяет сегодня представить конкретные молекулярные механизмы возникновения побочных эффектов НПВП и определить факт гастротоксичности данных препаратов как совершенно закономерное явление. Речь идет об исследованиях природы, структуры и биологических эффектов простагландинов.
Еще в начале нашего века было известно, что водные и спиртовые экстракты, полученные из половых желез многих видов животных и предстательной железы человека, понижают кровяное давление у собак и кроликов. Тогда же было сделано предположение о существовании в предстательной железе «неизвестного сосудистого гормона». В 1930 г. группа гинекологов из Колледжа врачей и хирургов Колумбийского университета обнаружила, что во время искусственного оплодотворения семенная жидкость вызывает сокращения и расслабления гладкой мускулатуры матки. В 1935 году Ulf Von Euler, шведский физиолог, изучая субстанцию Р – вещество белковой природы, обладающее способностью понижать кровяное давление и стимулировать сокращение стенок кишечника, обнаружил активное вещество экстрактов предстательной железы и семенной жидкости не в белковой фракции, а во фракции жирорастворимых кислот. U. Von Euler описал некоторые химические и фармакологические свойства активного экстракта, назвав его простагландином (от glandula prostata), и предположил, что простагландин имеет широкое регуляторное значение в организме. Но ни выделить вещество в чистом виде, ни изучить химическую структуру простагландина в то время не позволял примитивный уровень аналитических способов исследования. В 1970 г. U. Von Euler совместно с B. Katz и J. Axelrod была присуждена Нобелевская премия по физиологии и медицине «за открытия, касающиеся гуморальных медиаторов нервных окончаний и механизмов их хранения, выделения и инактивации», включавшие и открытие простагландинов.
Работу над простагландинами U. Von Euler продолжил его ученик Sune K. Bergström, в 1957 году получивший несколько миллиграммов чистого вещества в кристаллическом состоянии, назвав его «простагландин F» за его растворимость в фосфатном буфере. Затем в кристаллическом же состоянии был получен простагландин Е (обозначение возникло от слова ester – эфир, которым извлекался этот простагландин). Оба соединения были одинакового молекулярного веса и очень сходного строения, но в корне различались биологическими свойствами: простагландин Е понижал кровяное давление, а простагландин F сокращал гладкую мускулатуру. Первый этап в изучении простагландинов закончился в 1964 г.. К этому времени были выявлены биологические свойства индивидуальных простагландинов, некоторые соединения были получены в кристаллическом состоянии, определена их структура и найдены их предшественники. Ими оказались ненасыщенные, с несколькими двойными связями, жирные кислоты; в частности, предшественником первых известных тогда простагландинов была арахидоновая кислота. В течение нескольких последующих лет изучались пути образования простагландинов. В ходе своих работ S. Bergström и B. Samuelsson обнаружили, что арахидоновая кислота и ферменты, необходимые для образования из нее простагландинов, содержатся во всех ядерных клетках животных. Разные ткани выделяют разные простагландины, выполняющие в свою очередь различные биологические функции. Наиболее детально были изучены простагландины групп Е и F. Оказалось, что простагландины группы Е обладают сосудорасширяющим действием, т. е. снижают тонус стенок кровеносных сосудов, приводя тем самым к снижению артериального давления. Кроме того, они могут оказаться полезными для лечения больных с поражениями периферических сосудов, проявляющимися ухудшением кровотока в них, а также для лечения определенных врожденных заболеваний сердечнососудистой системы. Простагландины группы Е защищают слизистую оболочку желудка от образования язв и токсического действия аспирина и индометацина (противовоспалительных препаратов). Простагландины группы F обладают сосудосуживающим действием: они вызывают сокращение гладких мышц стенок кровеносных сосудов и, следовательно, повышение артериального давления. Кроме того, они стимулируют гладкую мускулатуру матки и в связи с этим могут использоваться для искусственного прерывания беременности. В 1972 – 1976 годах S. Bergström, B. Samuelsson и John Vane получили в чистом виде еще 10 простагландинов, установили их структуру и определили биологические свойства. В 1979 году B. Samuelsson с коллегами открыл еще один тип биологически активных соединений – близкие к простагландинам лейкотриены.
С помощью высокочувствительных химических и биологических методов анализа английский химик и фармаколог J. Vane обнаружил, что простагландины двух разных групп являются причиной появления характерных признаков воспаления, включая покраснение, боль, отек, гипертермию. J. Vane предположил, что эти быстро инактивируемые вещества эффективны только локально, в месте своего высвобождения. По этой причине они не могут считаться гормонами, как, например, гидрокортизон или адреналин, которые циркулируют в крови. В целом ряде исследований тех лет было показано, что простагландины выполняют ряд важнейших биологических функций: являются медиаторами и модуляторами воспалительной реакции, вызывая локальное расширение сосудов, отек, экссудацию, миграцию лейкоцитов и др. (в основном PgЕ2 и PgI2), сенсибилизируют рецепторы к медиаторам боли (гистамину, брадикинину) и механическим воздействиям, понижая порог болевой чувствительности, повышают чувствительность гипоталамических центров терморегуляции к действию эндогенных пирогенов (интерлейкина-1 и др. ), образующихся в организме под влиянием различных внешних и внутренних раздражителей (вирусы, микробы, токсины). Именно на этом основании в 1971 году J. Vane выдвинул гипотезу, согласно которой именно антипростагландиновая активность лежит в основе противовоспалительного, анальгезирующего и жаропонижающего действия НПВП. В дальнейшем, используя соединения с радиоактивными метками, J. Vane показал, что аспирин и подобные ему вещества (НПВП) блокируют синтез простагландинов указанных групп, являясь ингибиторами фермента циклооксигеназы. Таким образом, несмотря на почти столетнее использование ацетилсалициловой кислоты в качестве лекарственного средства, объяснение механизма ее действия на организм появилось лишь в 1970-х годах. Сформулированная J. Vane «простагландиновая» гипотеза механизма действия НПВП объяснила и некоторые побочные эффекты действия аспирина, прежде всего – возникновение эрозивно-язвенного процесса в желудке. В знак признания колоссальной научной значимости и важности для теоретической и клинической медицины исследований структуры и биологических эффектов простагландинов S. Bergström, B. Samuelsson и J. Vane в 1982 году была присуждена Нобелевская премия по физиологии и медицине «за открытия, касающиеся простагландинов и близких к ним биологически активных веществ», а J. Vane, кроме этого, был удостоен титула рыцаря высочайшим повелением королевы Великобритании Елизаветы II.
В ходе дальнейших исследований в 1991 году в лаборатории J. Vane было открыто существование двух изоформ (изоферментов) циклооксигеназы: циклооксигеназы 1 типа (ЦОГ-1) и циклооксигеназы 2 типа (ЦОГ-2). Было установлено, что синтез этих изоферментов кодируется различными генами, они отличаются между собой по молекулярной структуре и обладают различной, хотя и частично перекрещивающейся биологической активностью [43]. В последние годы была открыта еще одна изоформа – ЦОГ-3, которая является дериватом ЦОГ-1, локализуется преимущественно в клетках коры головного мозга и блокируется парацетамолом, метамизолом и фенацетином. Открытие изоформ ЦОГ впервые позволило выделить не только химические, но и «патофизиологические» классы НПВП и ненаркотических анальгетиков. Исследования G. Rosen и P. Needleman (1989 г. ), определивших генетическое и структурное отличие между изоформами ЦОГ, и последующие исследования позволили сформулировать концепцию «структурных» и «патологических» простагландинов, согласно которой ЦОГ-1 является конститутивным защитным ферментом, обладающим цитопротективным действием и закономерно присутствующим во многих тканях организма, в то время как ЦОГ-2 обладает провоспалительной активностью и накапливается в больших концентрациях только в очагах воспаления. В это же время стало ясно, что большинство побочных явлений при терапии НПВП связаны с ингибированием именно ЦОГ-1, а противовоспалительный эффект НПВП – ингибированием ЦОГ-2. С этого времени эффективность и безопасность НПВП стала ассоциироваться с избирательным (селективным) подавлением ЦОГ-2. Данное положение стало теоретической предпосылкой для разработки новых НПВП и отбора среди уже имеющихся препаратов средств с наибольшей избирательностью по отношению к ЦОГ-2, лечение которыми было бы высокоэффективным и в то же время максимально безопасным.
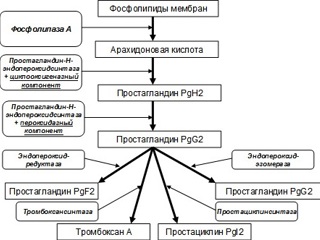
Существующие на сегодняшний день представления о синтезе и биологических эффектах простагландинов (Pg) кратко можно изложить следующим образом. Основой синтеза простагландинов является энзимная трансформация арахидоновой кислоты. Арахидоновая кислота образуется из фосфолипидов клеточных мембран под влиянием фермента фосфолипазы А2. Простагландины образуются из арахидоновой кислоты с помощью двух типов последовательно включающихся ферментов. Первый фермент работает по универсальному механизму, и независимо от того, в каком органе или ткани идет синтез, заканчивается он образованием PgH2 (отсюда и название фермента – простагландин-Н-синтетаза). Второй фермент (вернее, группа ферментов, объединяемая общим названием конвертазы) строго специфичен: в каждом типе тканей PgH2 превращается в свойственный только этому типу тканей простагландин. Например, в тканях мозга образуется PgD2, в тканях репродуктивной системы – PgE2 и PgF2, в клетках эндотелия – PgI2, в тромбоцитах – тромбоксан A2. Биотрансформацию арахидоновой кислоты в PgH2 регулирует фермент циклооксигеназа (ЦОГ) – простагландин-Н-синтетаза, рН-эндопероксидсинтетаза. ЦОГ представляет собой полиферментный комплекс, включающий диоксигеназу, изомеразу, редуктазу и другие компоненты. ЦОГ является гемопротеином, находится в эндоплазматической сети вблизи мест высвобождения араходоновой кислоты из мембранных фосфолипидов. ЦОГ в присутствии молекулярного кислорода и ряда кофакторов катализирует две ключевые реакции в превращениях арахидоновой кислоты, приводящие к образованию циклических эндоперекисей: 1) окисление с присоединением кислорода к молекуле арахидоновой кислоты с образованием промежуточного соединения – PgН2, 2) конверсия PgН2 в PgG2, который является предшественником других типов простагландинов (Е, F), а также простациклина и тромбоксанов А2 и В2. Ряд Pg (особенно серии Е) относится к числу основных медиаторов и модуляторов воспалительных реакций – расстройств микроциркуляции, развития отека, повышенной болевой чувствительности, гипертермии. Тромбоксан (TX), синтезирующийся из арахидоновой кислоты в тромбоцитах, является мощным фактором их агрегации. Образующийся в сосудистой стенке простациклин (PgI2), напротив, ослабляет агрегацию тромбоцитов и способствует расширению сосудов. Эффекты простагландинов усиливаются свободными радикалами «гидрокси»-типа, которые образуются при ферментативном окислении арахидоновой кислоты и повреждают клеточные мембраны, способствуют высвобождению агрессивных лизосомальных ферментов.
Циклооксигеназа 1 типа (ЦОГ-1) является физиологическим, «конститутивным», ферментом, постоянно присутствующим во многих тканях (тромбоцитах, сосудистом эндотелии, слизистой оболочке желудка, почечных канальцах) ; его синтез сравнительно не намного (в 2–4 раза) повышается при воспалении. Образующиеся PgI2 и PgE2 выполняют защитные функции в слизистой оболочке желудка, эндотелии, регулируют кровоток в почках. Циклооксигеназа 2 типа (ЦОГ-2) в здоровом организме содержится в очень малых количествах. Синтез ЦОГ-2 происходит в макрофагах, моноцитах, синовиоцитах, фибробластах, хондроцитах, эндотелиальных клетках под влиянием факторов, активирующихся при воспалении: цитокинов (интерлейкины, фактор некроза опухоли), свободных радикалов кислорода, липополисахаридов, активатора тканевого плазминогена, митогенных факторов и др. Уровень ЦОГ-2 существенно (в 10–80 раз) увеличивается при воспалении, в связи с чем ее считают патологическим (индуцибельным) ферментом. ЦОГ-2 играет ключевую роль в образовании т. н. провоспалительных ПГ, поэтому ее ингибирование лежит в основе терапевтического действия НПВП. Вместе с тем в некоторых тканях ЦОГ-2 играет роль физиологического («структурного») фермента (мозг, почки, кости, репродуктивная система).
Таблица 1. Сравнительная характеристика изоферментов ЦОГ-1 и ЦОГ-2 [22].
Сравниваемые показатели | Изоформы | |
ЦОГ-1 | ЦОГ-2 | |
Условия синтеза | Конститутивная | Индуцибельная |
Регуляция синтеза | Общая | Местная |
Тканевая экспрессия | Тромбоциты, эндотелий, почки, желудок и др. | Активированные моноциты, фибробласты, синовиоциты, предстательная железа, мозг и др. |
Предполагаемая роль | Синтез ПГ, регулирующих микроциркуляцию, функции почек, желудка | Синтез ПГ, участвующих в механизмах воспаления, деления клеток |
Факторы, стимулирующие синтез | Физиологические | Воспалительные |
Кратность повышения синтеза под влиянием стимулирующих факторов | В 2–4 раза | В 10–80 раз |
Кодирующие гены | 22 kb + 11 аминокислотных остатков (экзонов) | 8, 3 kb + 10 аминокислотных остатков (экзонов) |
Молекулярная масса | 70 кД | 70 кД (гомология с ЦОГ-1 – 60 %) |
Локализация в клетке | Цитоплазма | Околоядерная область |
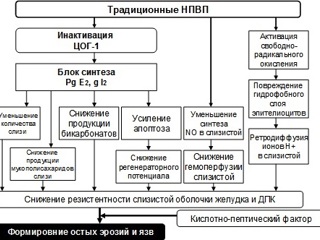
Основной точкой приложения при действии НПВП является ингибирование энзимной активности компонента циклооксигеназы – эндопероксидсинтазы. Процесс ингибирования обусловлен ковалентной или нековалентной связью НПВП с данным ферментом. Очевидно, что результаты ингибирования ЦОГ-1 и ЦОГ-2 принципиально различаются, соответственно их биологическим функциям. Еще J. Vane показал, что именно с ингибированием ЦОГ-1 и ослаблением физиологической роли простагландинов в основном и связаны побочные эффекты НПВП, прежде всего со стороны желудочно-кишечного тракта. Они обусловлены устранением гастропротекторной функции простагландина PgЕ2, снижением пролиферативной способности клеток слизистой оболочки пищеварительного тракта, ухудшением микроциркуляции в ней. Именно влияние НПВП на ЦОГ-1 приводит к эрозивно-язвенному повреждению слизистой оболочки ЖКТ более чем у 30 % пациентов. В механизме кровотечений, вызванных НПВП, кроме того, играет роль снижение количества тромбоцитов и их агрегационной способности (подавление синтеза ТХ). Из последствий НПВП-индуцированного повреждения наиболее серьезны эрозии и язвы, кровотечения и перфорации, которые могут возникать не только в желудке, но и в пищеводе, двенадцатиперстной кишке и в нижних отделах кишечника. Особенно вероятны эти побочные эффекты в пожилом возрасте. Их опасность связана и с тем, что кровотечения и перфорации желудочно-кишечного тракта могут возникать без каких-либо предвестников. Гастротоксическое действие дозозависимо: его риск при использовании высоких доз НПВП может повышаться более чем в 8 раз. Более того, к настоящему времени стало очевидным, что сопоставление ингибирующей активности препарата по отношению к ЦОГ2 и ЦОГ-1 позволяет судить о его потенциальной токсичности. Риск развития тяжелых осложнений существенно выше на фоне приема тех препаратов, которые обладают низкой селективностью в отношении ЦОГ-2. Очевидно, что чем меньшее значение имеет соотношение ЦОГ1/ЦОГ2, тем избирательнее препарат в отношении ЦОГ-2 и, соответственно, менее токсичен.
Продолжая рассмотрение в исторической ретроспективе проблемы токсических эффектов НПВП в отношении пищеварительного тракта, следует обратить свое внимание на эволюцию научных взглядов в отношении проблемы гастродуоденальных язв вообще и НПВП-индуцированного гастродуоденального повреждения в частности. Очевидно, что на протяжении более чем векового изучения гастродуоденальных язв, научные представления об этиологии эрозивно-язвенного поражения гастродуоденальной зоны и собственно механизмах ульцерогенеза претерпевали значительные, порой даже революционные, изменения. Многие десятилетия понятия «гастродуоденальная язва» и «язвенная болезнь» считались синонимичными. Основные концепции язвообразования в желудке и двенадцатиперстной кишке включали: воспалительную, «гастритическую» теорию (Ф. Уден – G. E. Konjetzny, 1817 – 1923), инфекционную теорию (Labert – M. Letull – E. Payr, 1851 – 1888 – 1907), сосудистую теорию (R. Virchow, 1852), пептическую теорию (C. Bernard – H. Quincke, 1856 – 1878), травматическую теорию (L. Aschoff, 1912), нейрорефлекторную теорию (Rossle, 1912), нейровегетативную теорию (G. Bergmann, 1913), нейротрофическую теорию (А. Д. Сперанский, 1935), кортико-висцеральную теорию (К. М. Быков – И. Т. Курцын, 1949), теорию стресса (Selye, 1953), теорию слизистого барьера (Hollander - Johnson, 1954 - 1957), теорию кислотно-пептического фактора (L. R. Dragstedt, 1956), теорию атрофии слизистой (A. Shay, 1959). При этом наиболее логичной и доказанной экспериментально и клинически была признана кислотно-пептическая теория язвообразования [7, 12, 18]. Вместе с тем последнее десятилетие ХХ века в работах ряда авторов называется не меньше чем «революцией в гастроэнтерологии» и связывается с феноменальным прецедентом рождения новой науки, посвященной единственному микроорганизму, хеликобактериологии. Новым поводом к «переоценке ценностей» в лечении язвенной болезни, в том числе осложненной кровотечением, послужило открытие (к слову, также отмечено Нобелевской премией) в 1983 году B. Marshall и J. Warren вегетирующих в слизистой антрального отдела желудка спиралевидных микроорганизмов, называемых ныне Helicobacter pylori, и возрождение инфекционно-гастритической теории язвообразования. В конце 80-х – середине 90-х годов большинство гастроэнтерологов восторженно утверждали об очень своевременной находке недостающего звена в патогенезе язвенной болезни, находя все новые доказательства чрезвычайной патогенности Helicobacter pylori (HP). Негативное влияние – локальное и даже системное, приписываемое хеликобактеру, буквально затмило патогенность таких микробиологических монстров, как Y. рestis и V. сholerae. Наверное, в те годы не нашлось бы гастроэнтеролога-терапевта, который бы не знал, что НР является основным этиопатогенетическим фактором язвообразования как минимум в 80 - 90% случаев, и что язвенная болезнь связана именно с персистенцией НР и, соответственно ликвидируется при эрадикации хеликобактера (вспомним давний постулат о том, что язвенная болезнь хорошо лечится, но плохо излечивается). Все остальные факторы язвообразования либо признавались малозначимыми, либо их действие считалось только вторичным, непременно инициированным патогенностью НР.
«Ибо будет время, когда здравого учения принимать не будут, но по своим прихотям будут избирать себе учителей, которые льстили бы слуху». (Ап. Павел, 2-е Тим. , 4 – 4).
Однако на рубеже веков все большее число исследователей подвергают сомнению ведущую роль НР в этиопатогенезе язвенной болезни, задаваясь, пожалуй, единственным вопросом «что есть хеликобактер: причина или следствие?». Сегодня известно, что при почти 100% инфицированности НР населения Африки, язвенная болезнь развивается лишь у 5 - 10% из всей популяции. Уже доказано, что в США язвенная болезнь связана с НР всего в 42% случаев. Неприятно диссонирует с утверждениями о ведущей в лечении язвенной болезни роли эрадикации НР тот факт, что после эрадикации НР рецидив язвы наблюдается не менее, чем у 20% больных.
Справедливости ради следует заметить, что, обсуждая этиопатогенетические перипетии язвенной болезни, многие исследователи еще столетие назад указывали на возможность возникновения изъязвлений в гастродуоденальной зоне, не связанных с язвенной болезнью, называя их «симптоматическими» или «острыми» язвами. В самих этих терминах прослеживается четко подмеченная связь между провоцирующим фактором, коротким анамнезом заболевания и образованием язвы. По различным данным сегодня острые язвы составляют до 12% от всех причин геморрагий начального отдела пищеварительного тракта, сопровождаясь летальностью, достигающей 40 – 70%. По данным J. Heinkelein (1979) острые гастродуоденальные язвы были впервые описаны Цельсом у раненых во время римских войн. Детальное описание острых гастродуоденальных язв и их осложнений началось с 1842 года, когда T. Curling привел данные об острых язвах ДПК у обожженных. Cвязь возникновения острых язв с оперативными вмешательствами отметил в 1896 году A. Eiselsberg, с септическим состоянием – в 1867 году Th. Billroth, а H. Cushing в 1932 году описал острые язвы у больных с повреждениями гипоталамуса. Первое морфологическое описание острой язвы сделал R. Virchov в 1849 году, установив патогенетическую связь острого изъязвления с нарушением гемоперфузии в области язвы. В 1896 году Dieulafoy указал на признаки, принципиально отличающие острые язвы от хронических – отсутствие рубцового поля и воспалительной реакции. Наряду с послеожоговыми, нейрогенными, послеоперационными, стрессовыми при остром инфаркте миокарда и острой сердечной недостаточности, септическими, уремическими гастродуоденальными язвами достаточно давно были описаны и лекарственные изъязвления в желудке и ДПК. Одной из разновидностей острых язв традиционно было принято считать лекарственные язвы, прежде всего язвы, развившиеся при применении АСК и других НПВП.
Как было указано выше, связь между приемом прообраза НПВП – салициловой кислоты – и поражением гастродуоденальной зоны была выявлена еще в XIX веке. Спорадически работы, посвященные НПВП-индуцированному повреждению желудка и ДПК появлялись и в первой половине XX века. Так, A. Douthwait и J. Lintott в 1938 г. представили в Lancet описание эндоскопической картины эрозий слизистой желудка, возникших на фоне приема аспирина. Любопытно, что в нашей стране уже с 30–х годов XX века по инициативе Г. Л. Брандербургского стал обсуждаться вопрос об улучшении гастродуоденальной переносимости растворов салицилатов путем добавления в них гидрокарбоната натрия. Однако детальное изучение данной патологии началось только в 60-е годы прошлого столетия. Именно тогда исследователи из Румынии впервые применили термин «медикаментозная гастропатия», преследуя цель разграничения НПВП-индуцированного поражения гастродуоденальной слизистой от гастрита – состояния, связанного с воспалением слизистой оболочки желудка. В 1971 г. в «Клинической медицине» была опубликована передовая статья В. Х. Василенко «Влияние некоторых противоревматических средств на слизистую оболочку желудка». В данной работе, представлявшей обзор отечественных и зарубежных исследований по проблеме медикаментозных гастропатий, помимо данных о патологии ЖКТ, связанной с влиянием салицилатов и АСК, авторы приводили также сведения по ульцерогенности относительно новых на то время НПВП – ибупрофена и индометацина. Исследования 80–90–х годов позволили охарактеризовать основные особенности НПВП–индуцированных гастропатий: острый характер язв и эрозий, отсутствие типичной для язвенной болезни локализации повреждения, умеренно выраженную субъективную симптоматику язвенного поражения и зачастую ее полное отсутствие. В 1986 году S. H. Roth предложил использование термина NSAID-gastropathy (НПВП-гастропатия) для обозначения эрозивно-язвенных поражений гастродуоденальной зоны, связанных с приемом НПВП и имеющих характерные клинико-эндоскопические особенности. Критерии диагностики НПВС-гастропатии были разработаны под руководством В. А. Насоновой в 1991 году. Специфические особенности этих поражений — появление на фоне применения НПВП острых, обычно множественных гастродуоденальных эрозий и/или язв с преимущественной локализацией в антральном отделе желудка; отсутствие локального воспаления и гистологических признаков гастрита; мало- или асимптомное течение и частая манифестация только при развитии осложнений; склонность язв к заживлению при отмене НПВП.
Очевидно, что детальное изучение НПВП-индуцированной гастропатии стало возможным лишь при широком внедрении в клиническую практику фиброэндоскопии. Принято считать, что первые попытки прижизненной визуализации внутренней поверхности полых органов, в том числе и пищевода, были предприняты еще в 90-х годах XVIII столетия Bazzini в Германии, Segales во Франции и Bombolzini в Италии. Первый гастроскоп был сконструирован J. Mikulicz в 1881 году; автору первому удалось наблюдать внутреннюю поверхность желудка и некоторые патологические процессы, включая раковую инфильтрацию. Впоследствии стали применяться жесткие, полужесткие и мягкие гастроскопы конструкций Kausch (1907), Zussman (1911), Schindler (1923), Sternberg (1923). С целью диагностики желудочного кровотечения гастроскопию впервые произвели в 1925 году независимо друг от друга Jackson и Korbsch, указав на возможность проведения дифференциального эндоскопического диагноза между различными причинами геморрагии. Новая эра в эзофагогастроскопии наступила с внедрением в клиническую практику эндоскопов с фиброволоконной оптикой. В 1963 году Hirschowitz, Luketic, Balint и Fulton, обследуя гастрофиброскопом 245 больных с острыми кровотечениями из верхнего отдела пищеварительного тракта, поставили правильный диагноз в 88% случаев. Примерно в это же время многие исследователи представили эндоскопические доказательства того, что АСК может являться причиной повреждения слизистой желудка. По счастливому стечению обстоятельств начало повсеместного использования фиброэноскопии в госпитальной и амбулаторной практике по времени совпало с фундаментальными теоретическими изысканиями в области патогенеза нестероидного повреждения гастродуоденальной зоны, что позволило представить клиницистам современное видение проблемы НПВП-индуцированных гастропатий.
В настоящее время, согласно МКБ-10 диагноз НПВП-индуцированного поражения формулируется следующим образом: «НПВП-гастропатия: язва желудка, осложненная кровотечением» (Y 45. 8, K 25, K 92). Но следует указать и на встречающуюся (прежде всего – по вине англоязычных авторов) некоторую терминологическую путаницу. Так, термины «пептическая язва» (peptic ulcer) и «язвенная болезнь» (ulcer disease) в западной литературе часто рассматриваются как синонимы. Поэтому зачастую диагнозом «язвенная болезнь» обозначают рецидивирующую пептическую язву у пациентов, длительно принимающих НПВП: «Важнейшими причинами развития язвенной болезни является Helicobacter pylori и прием НПВП» - указывает D. Graham (1996). J. DelValle (1997) в руководстве по патофизиологии органов пищеварения вообще указывает, что «язвенная болезнь представляет собой группу гетерогенных заболеваний, общим проявлением которых является локальный дефект или эрозирование в слизистой оболочке желудка и/или ДПК». В отечественной литературе понятия НПВП-индуцированная гастропатия и язвенная болезнь, как правило, четко дифференцируются. При этом НПВП у пациентов без клинико-анамнестической картины язвенной болезни является этиологическим фактором именно НПВП-гастропатии. У пациентов же с язвенной болезнью возникновение эрозивно-язвенных поражений гастродуоденальной зоны во время НПВП-терапии обычно трактуется как обострение язвенной болезни. Как показали исследования, НПВП не влияют на степень обсеменения HР слизистой оболочки гастродуоденальной зоны, на активность и степень воспаления при H. pylori-индуцированном гастрите. Тем не менее, НПВП могут вызывать обострение язвенной болезни с развитием осложнений в виде кровотечения или перфорации, чему способствуют их дезагрегационный эффект, усиление апоптоза, угнетение пролиферации.
С другой стороны объединение зарубежными авторами всех язвенных поражений гастродуоденальной зоны вне зависимости от их этиологии в одно понятие «пептическая язва» очевидно, имеет под собой некую основу. Действительно, сложно представить себе, что типовой патологический процесс острой дистрофии и некроза слизисто-подслизистого слоя верхних отделов пищеварительной трубки с формированием язв при каждом этиологическом факторе происходит по своему оригинальному сценарию. Патофизиологи часто приводят максиму о том, что «наш организм – не полиглот», стремясь унифицировать модели развития патологических процессов. Забегая вперед, отметим, что подтверждением правомочности такого подхода в отношении гастродуоденальных язв является назначение одних и тех же базисных средств фармакотерапии – антисекреторных препаратов – при язвенном процессе любой этиологии. Но, справедливости ради следует отметить, что в современных отечественных руководствах (именно – руководствах, а не монографиях) можно увидеть аналогичное западному видение проблемы. Так, в «Рекомендациях по диагностике и лечению язвенной болезни» Минздрава РФ (2002) под редакцией В. Т. Ивашкина, А. А. Шептулина, Е. К. Баранской и др. приводятся следующие положения. Согласно современным представлениям, патогенез язвообразования в общем виде сводится к нарушению равновесия между факторами кислотно-пептической агрессии желудочного содержимого и элементами защиты слизистой оболочки желудка и двенадцатиперстной кишки.
К агрессивным факторам относятся повышение выработки соляной кислоты (в результате увеличения массы обкладочных клеток, гиперпродукции гастрина, нарушения нервной и гуморальной регуляции процессов секреции соляной кислоты), увеличение выработки пепсиногена и образования пепсина, нарушения моторики желудка и двенадцатиперстной кишки (задержка или ускорение эвакуации кислого содержимого из желудка), прямое травматизирующее действие пищи. В настоящее время установлено, что важнейшую роль в усилении агрессивных свойств желудочного содержимого и ослаблении защитных свойств слизистой оболочки желудка и двенадцатиперстной кишки играют микроорганизмы Helicobacter pylori (НР). Обсеменение слизистой оболочки желудка НР сопровождается развитием поверхностного антрального гастрита и дуоденита и ведет к повышению уровня гастрина и снижению уровня соматостатина с последующим усилением секреции соляной кислоты. Избыточное количество соляной кислоты, попадая в просвет двенадцатиперстной кишки, в условиях относительного дефицита панкреатических бикарбонатов способствует прогрессированию дуоденита и, кроме того, обусловливает появление в двенадцатиперстной кишке участков желудочной метаплазии (перестройки эпителия дуоденальной слизистой оболочки по желудочному типу), которые быстро заселяются НР. В дальнейшем при неблагоприятном течении, особенно при наличии дополнительных этиологических факторов (курение, нервно-психические стрессы, алиментарные погрешности, прием ульцерогенных лекарственных препаратов и др. ), в участках метаплазированной слизистой оболочки желудка формируется язвенный дефект. У 5-10% больных с дуоденальными язвами и у 15-20% пациентов с язвами желудка развитие заболевания может происходить без участия НР. В первую очередь, это относится к симптоматическим гастродуоденальным язвам.
К ослаблению защитных факторов слизистой оболочки желудка и двенадцатиперстной кишки приводят снижение продукции и нарушение качественного состава желудочной слизи, уменьшение выработки бикарбонатов, ухудшение процессов регенерации и кровотока в слизистой оболочке, снижение содержания простагландинов в стенке желудка. Несмотря на неоднократную и подчас очень жесткую критику, концепция «весов Shay», объясняющая язвообразование перманентной гиперактивностью эндо- и экзогенных агрессивных факторов или/и ослаблением защиты слизистой оболочки, пользуется наибольшей популярностью, поскольку является наиболее логичной, и, главное, определяет основные направления лечебных мероприятий. Исходя из данной концепции приоритетным патогенетическим звеном при язвенной болезни принято считать действие факторов агрессии, при НПВП-индуцированных язвах – дефицит факторов защиты.
Учитывая, что механизмы защиты слизистой оболочки желудка, включающие выработку слизи, секрецию бикарбонатов, достаточную гемоперфузию слизисто-подслизистого слоя, поддержание камбиальной пролиферации эпителиоцитов и регуляцию их апоптоза, контролируются простагландинами, основной механизм развития НПВП-индуцированных язв желудка и ДПК связан с блокированием синтеза простагландинов нестероидными препаратами. При этом угнетение НПВП активности именно ЦОГ-1 и приводит к снижению синтеза простагладинов и простациклина в слизистой оболочке желудка. Помимо того, что снижение синтеза простагландинов приводит к уменьшению синтеза слизи и бикарбонатов, являющихся основным защитным барьером слизистой оболочки желудка от агрессивных факторов желудочного сока, при приеме НПВП снижается уровень простациклина и оксида азота, что неблагоприятно сказывается на кровообращении в подслизистой пищеварительной трубки. Дефицит простагландина PgІ2 ухудшает кровоток в стенке желудка, что следует считать чрезвычайно важным патогенетическим звеном НПВС-гастропатий. Снижение синтеза простагландина PgЕ2 ведет к уменьшению секреции бикарбонатов и слизи, к повышению кислотопродукции, усиливая дисбаланс факторов защиты и агрессии, что однако не позволяет назвать НПВП-гастропатию первично кислотозависимым заболеванием. Обнаружен местный повреждающий эффект НПВП на клеточном уровне, который не обусловлен простагладиновым механизмом. Уже через короткое время после введения НПВП наблюдается повышение проницаемости слизистой оболочки для ионов водорода и натрия. Предполагается, что НПВП (непосредственно или через провоспалительные цитокины) могут усиливать апоптоз эпителиальных клеток. НПВП поражают гидрофобный слой на поверхности слизистой оболочки, обедняют состав фосфолипидов, ингибируют секрецию компонентов желудочной слизи – гексозаминов, фукоз, мукополисахаридов. В механизме ульцерогенного действия НПВП определенную роль играет активация свободно-радикального окисления липидов. Образующиеся в результате токсического действия НПВП продукты свободнорадикального окисления принимают участие в поражении слизистой оболочки, а также в разрушении мукополисахаридов. Не исключено, что нарушение целостности компонентов слизистой оболочки связано не только с влиянием НПВП на синтез простагладинов, но также с уменьшением синтеза лейкотриенов, что тоже в свою очередь, приводит к уменьшению количества слизи, обладающей гастропротективными свойствами.
Местный повреждающий эффект НПВП в клинической практике подтверждается тем, что покрытые кишечно-растворимой оболочкой препараты в первую неделю применения вызывают значительно менее выраженное изменение слизистой оболочки желудка. Существует мнение о том, что в течение нескольких первых дней НПВП-терапии значительная роль в формировании эрозий и язв принадлежит местным повреждающим эффектам этих средств: будучи производными слабых органических кислот, большинство НПВП в кислой среде желудка не ионизированы и проникают через гидрофобные мембраны в цитозоль эпителиоцитов, вызывают появление эрозий и даже неглубоких язв, преимущественно верхних отделов желудка. Однако впоследствии при применении энтеросолюбильных форм также наблюдается появление желудочных язв и отнюдь не реже, чем терапии таблетированными формами. Данный факт, а также возникновение эрозивно-язвенных поражений желудка и ДПК при парентеральном применении НПВП, и при их применении в свечах, подтверждает утверждение о том, что системная супрессия синтеза простагладинов при терапии НПВП, и, следовательно, дефицит защитных резервов слизистой оболочки желудка и ДПК является одной из основных причин развития НПВП-индуцированной гастропатии, приводя к закономерному развитию осложнений в виде кровотечения и перфорации.
До последнего времени при изучении токсического влияния НПВП на пищеварительную трубку основное внимание уделялось патологии верхних отделов ЖКТ. Значительно менее изученной является проблема НПВП-индуцированного повреждения слизистой оболочки тонкой кишки. Поскольку простагландины и здесь играют ведущую роль в координации защиты слизистой, логично было предположить (и это подтверждалось секционным материалом) возможность развития НПВП-индуцированной энтеропатии. Сложности при разработке данной проблемы можно объяснить целым рядом объективных обстоятельств: отсутствием специфической клинической симптоматики эрозивно-язвенного поражения тонкой кишки, практически недоступностью тонкой кишки для прижизненного исследования вплоть до последнего времени, проблематичностью прижизненного морфологического исследования тонкой кишки.
Ситуация несколько изменилась с внедрением в практику капсульной энтероскопии (КЭС), позволившей визуализировать изменения слизистой на всем протяжении тонкой кишки, и методов, позволяющих оценить проницаемость слизистой. Использование этих методик показало, что НПВП-энтеропатия сопоставима по распространенности с НПВП-ассоциированной гастро-дуоденопатией, а по некоторым данным (D. Adebayo, I. Bjarnason, 2006) даже превосходит ее. Так, в исследовании L. Maiden et al. (2005) при помощи КЭС и определения калпротектина (маркера воспаления кишечника) поражение тонкой кишки было выявлено у 75% здоровых добровольцев, принимавших стандартную дозу ретардной формы диклофенака всего в течение 2 недель. Следует отметить, что энтеропатия при этом развилась на фоне параллельного приема стандартных доз ингибитора протонной помпы омепразола.
Механизмы НПВП-ассоциированного повреждения кишечника несколько отличаются от таковых в верхних отделах пищеварительной трубки. Помимо нарушения секреции слизи и гемоперфузии слизистой вследствие подавления синтеза простагландинов, они включают в себя прямое поражение слизистой (особо актуальное при использовании кишечнорастворимых форм препаратов), повреждение митохондрий, нарушение взаимодействия (связей) между энтероцитами, приводящее к повышению проницаемости слизистой оболочки кишечника для потенциальных патогенных факторов (бактерий и их токсинов, желчных кислот), и нейтрофильную активацию (P. Fortun, C. Hawkey, 2005). Пусковую роль в НПВП-опосредованном повреждении тонкой кишки может играть и транслокация кишечной микрофлоры в слизистую оболочку (A. Lanas, C. Scarpignato, 2006). Основными проявлениями НПВП-энтеропатии являются эрозивно-язвенные поражения слизистой и формирование стенозов. Как указывалось выше, клинические признаки этой патологии неспецифичны; они могут быть маловыраженными или вовсе отсутствовать. Чаще всего НПВП-энтеропатия манифестирует своими осложнениями: хронической железодефицитной анемией (ЖДА) и потерей белка через поврежденную слизистую оболочку («протеинтеряющая энтеропатия»), значительно реже возникает тонкокишечная непроходимость, в основе которой лежит образование так называемых диафрагмальных стриктур («diaphragm strictures»).
Выдвинутая еще J. Vein гипотеза о том, что анальгетический и противовоспалительный эффекты НПВП зависят от ингибирования активности ЦОГ-2, а развитие побочных реакций определяется подавлением активности ЦОГ-1, в настоящее время является твердо установленным фактом, имеющим совершенно определенное прикладное значение. Именно концепция наличия изоформ ЦОГ и послужила основой для разработки нового класса НПВП, так называемых селективных ингибиторов ЦОГ-2, позволяющих диссоциировать понятие эффективности и безопасности при избирательном подавлении ЦОГ-2 и одновременной интактности ЦОГ-1. Изначально постулировалось, что селективные ингибиторы ЦОГ-2 теоретически должны поддерживать терапевтические свойства НПВП с меньшим количеством побочных эффектов вследствие отсутствия влияния на продукцию «простагландинов защиты». В эксперименте было установлено, что место связывания НПВП с ЦОГ-2 структурно на 25% больше, чем место связывания с ЦОГ-1. У ЦОГ-2 также имеется вторичное место связывания с НПВП дополнительно к каталитическому центру. Это позволило в конце 1980-х – начале 1990-х создать лекарственные препараты, блокирующие активность ЦОГ-2 с минимальным эффектом на ЦОГ-1 в терапевтических концентрациях. Тогда же было показано, что одно и то же вещество может действовать как ингибитор ЦОГ-2 в низкой концентрации и как конкурентный ингибитор ЦОГ-1 в высокой, причем молекулярная основа для такого взаимодействия до сих пор не вполне понятна.
Результатом разработок исследовательских подразделений крупных фармацевтических компаний (Searl, Pfizer, Merсk & Co. и др. ) стало создание и внедрение в медицинскую практику НПВП нового поколения, таких как целекоксиб, рофекоксиб, эторикоксиб и других, объединяемых в соответствии с особенностями химического строения и селективностью ингибирования ЦОГ–2 в группу «коксибов». Следует отметить то обстоятельство, что в период, непосредственно предшествующий созданию коксибов (1970-е годы), в медицинскую практику вошли несколько НПВП, которые, как впоследствии было установлено, также оказывают преимущественное (но не селективное) влияние на ЦОГ–2 и вызывают меньше осложнений со стороны ЖКТ, чем традиционные противовоспалительные препараты. К ним относятся мелоксикам, этодолак и нимесулид. Абсолютно ошибочным является утверждение о том, что данные препараты специально были синтезированы как преимущественные ингибиторы ЦОГ-2, поскольку в клинической практике они появились задолго до открытия двух изоформ данного фермента. В основу современных классификаций НПВП положена избирательность действия в отношении изоформ ЦОГ. По данному признаку НПВП подразделяются на:
- ЦОГ-1 — селективные ингибиторы (низкие дозы АСК) ;
- ЦОГ — неселективные блокаторы (большинство традиционных НПВП, с которыми и связываются гастротоксические эффекты нестероидных препаратов) ;
- Преимущественные ЦОГ-2 — ингибиторы (мелоксикам и нимесулид, которые имеют меньшее количество побочных эффектов в сравнении со стандартными НПВП, но риск осложнений сохраняется при повышении вводимой дозы препарата) ;
- Селективные ЦОГ-2 — ингибиторы (целекоксиб, рофекоксиб, валдекоксиб, парекоксиб, эторикоксиб).
В момент появления в клинической практике коксибов разгорелись весьма горячие споры по поводу целесообразности выделения данных препаратов отдельный класс НПВП. В частности, во время дискуссии на симпозиуме Европейской Антиревматической Лиги (EULAR) в 2000 г. высказывались принципиально противоположные мнения о терминологических нюансах определения «специфичный» и «селективный», а также и об особом месте коксибов среди прочих НПВП, обладающих селективностью в отношении ЦОГ-2. Высказывались мнения о том, что термин «коксиб» отражает в первую очередь химическую структуру препарата, а не его принципиально новые фармакологические свойства, и о том, что коксибы мало чем отличаются от «старых селективных» ингибиторов ЦОГ-2. Тем не менее, сопоставление коэффициентов селективности НПВП в отношении ЦОГ-2 весьма красноречиво свидетельствует о реакционности (а зачастую и откровенном лукавстве) подобных «сомнений» (см. табл. 2).
Таблица 2. Коэффициент селективности НПВП в отношении ингибирования ЦОГ-1 и ЦОГ-2.
НПВП | Коэффициент селективности (IC50 ЦОГ-1 / IC50 ЦОГ-2) |
Ибупрофен | 10, 0 |
Диклофенак | 0, 33 |
Кетопрофен | 2, 0 |
Напроксен | 100, 0 |
Индометацин | 33, 0 |
Пироксикам | 2, 0 |
Нимесулид | 0, 15 |
Мелоксикам | 0, 20 |
Целекоксиб | 0, 10 |
Рофекоксиб | 0, 004 |
Возможно, что безусловное лидерство коксибов в ЦОГ-2 селективности является скорее количественным, нежели качественным показателем. Но вспомним диалектические взаимоотношения количества и качества! In vitro степень сродства целекоксиба по отношению к ЦОГ2 в зависимости от методики определения в 10–3000 раз выше, чем к ЦОГ-1, что значительно превосходит показатели таких преимущественных ингибиторов ЦОГ-2, как мелоксикам и нимесулид. Полагают, что подобная «разборчивость» коксибов связана с уникальной стереометрической структурой молекул. От традиционных НПВП их отличает наличие ригидной боковой цепи, способной проникать внутрь гидрофильной боковой полости молекулы ЦОГ-2 и тем самым неконкурентно блокировать активный центр этого изофермента. К тому же избирательность коксибов мало зависит от концентрации, тогда как у других НПВП она весьма относительна и проявляется главным образом в концентрациях, не превышающих терапевтические (так называемая дозозависимая селективность). Таким образом, представляется справедливым определение именно коксибов как селективных ингибиторов ЦОГ-2, что позволяет именно данные препараты в настоящее время считать безопасными в отношении пищеварительного тракта.
Помимо обсуждения проблемы гастро- и энтеротоксичности НПВП в последние несколько лет предметом широкой дискуссии является гепатотоксический потенциал данной группы препаратов. В конце 1970-х годов было доказано, что диклофенак натрия и АСК обладают токсическим действием на печень. Первоначально было описано повышение активности ферментов печени (трансаминаз, щелочной фосфатазы) на фоне приема АСК; позже были зарегистрированы случаи тяжелого лекарственного гепатита на фоне приема индометацина, диклофенака, фенилбутазона, сулиндака. К началу 1980-х годов было опубликовано около 50 работ, описывающих поражение печени более чем у 300 больных, лечившихся ацетилсалициловой кислотой (L. F. Perscott, 1981). Почти в 3% случаев оно было тяжелым, у двух пациентов имел место летальный исход. С приемом аспирина также связывают так называемый синдром Рея, при котором сочетаются острое поражение печени (жировая дегенерация, некроз, портальное и перипортальное воспаление), гипогликемия, ацидоз, выраженная энцефалопатия у детей и подростков. В связи с этим с 1980 г. были сделаны предостережения по применению аспирина у детей, актуальные и сегодня. Далее последовал целый ряд публикаций в «British Medical Journal», посвященных гепатотоксическому действию нимесулидов. Фатальные случаи, связанные с тяжелыми нарушениями функции печени при приеме индометацина у детей, послужили основанием для того, чтобы не рекомендовать этот препарат до 11-летнего возраста. Были описаны и случаи холестаза на фоне приема НПВП. На сегодня известно, что у 1-5% больных, регулярно принимающих НПВП, наблюдается бессимптомное повышение уровня трансаминаз. Клинически выраженные гепатотоксические реакции, такие как острый лекарственный гепатит, отмечаются редко – около 1 случая на 10 тыс. пациентов в год. Такой вывод был сделан после суммирования информации пяти популяционных исследований, охвативших более 1 миллион больных (A. M. Walker, 1997). Однако, несмотря на сравнительно невысокую частоту, поражение печени на фоне терапии НПВП принимает опасный для жизни характер, сопровождаясь холестатической желтухой или фульминантной печеночной недостаточностью. Таким образом, несмотря на то, что гепатотоксические реакции в структуре побочных эффектов НПВП не занимают ведущие позиции, широчайшая распространенность препаратов этой группы и длительность их приема обусловливает весьма значительное количество случаев НПВП-индуцированных поражений печени.
Исходя из возможностей трактовки самого понятия «побочные эффекты», последние могут иметь не только негативное, но и позитивное значение. Ярким примером этому служит выявленный в последние десятилетия феномен предотвращения злокачественной трансформации толстокишечных полипов при терапии НПВП по поводу локальной или системной воспалительной реакции. На сегодняшний день возможность профилактики развития рака ободочной и прямой кишки некоторыми НПВП является доказанным фактом. Более того, в ряде государств, помимо ревматической и неврологической патологии, показанием для назначения отдельных НПВП (например, целекоксиба) служит профилактика развития колоректального рака. Изначально эмпирически было установлено, что у больных, длительно принимавших АСК по поводу ревматологической патологии, частота колоректального рака значительно ниже, чем в популяции в целом. Экспериментальными исследованиями 1990-х и начала 2000-х годов было показано, что гиперэкспрессия ЦОГ-2 и гиперпродукция PgE2 в клетках толстокишечного эпителия, обусловленная генными и хромосомными мутациями, приводит к усилению клеточной пролиферации, супрессии апоптоза, стимулирует неоангиогенез и усиливает процессы свободно-радикального окисления. Данное объяснение злокачественной трансформации толстокишечных полипов является на сегодняшний день наиболее аргументированным и логичным. И, что самое главное, из данного объяснения следует реальная возможность целенаправленного воздействия на процесс канцерогенеза при КРР – медикаментозное ингибирование ЦОГ-2 НПВП.
Таким образом, краткий исторический обзор развития наших представлений о побочных эффектах НПВП со стороны пищеварительного тракта может еще раз иллюстрировать эволюцию научного подхода к изучаемой на протяжении двух веков проблеме: от эмпирической констатации фактов до патогенетически обоснованных разработок лекарственных препаратов. При этом глубоко символичным представляется то обстоятельство, что именно побочные эффекты НПВП явились тем стимулом, благодаря которому и были установлены весьма значимые компоненты сложнейшего механизма воспаления, защиты слизистой оболочки пищеварительной трубки, а также некоторые аспекты канцерогенеза. Безусловно, по мере накопления фактического экспериментального и клинического материала неизбежно расширяется и палитра «белых пятен» в столь многогранной проблеме. Тем не менее, имеющийся на сегодняшний день весьма обширный научный потенциал, имеющий, прежде всего, прикладное значение, позволяет практическому врачу проводить терапию нестероидными противовоспалительными препаратами, в полной мере контролируя ее эффективность и безопасность.
© М. А. Евсеев
26 марта 2016 г.
Ещё больше полезной информации на нашем Телеграм-канале