Согласно определению Malnutrition Advisory Group of the British Assotiation for Parenteral and Enteral Nutrition (BAPEN) нутритивной недостаточностью считается нутритивный статус, при котором дефицит энергии, белка или других нутриентов вызывает существенные (измеряемые) негативные эффекты на тканевом, органном уровнях и функционировании систем организма. В настоящее время тезис о том, что белково-энергетическая недостаточность и связанные с ней осложнения и летальные исходы являются важнейшей составляющей тяжелого хирургического заболевания или травматического повреждения уже не является оригинальным утверждением. Хорошо известно, что ранняя адекватная нутритивная поддержка, представленная различными сочетаниями методик парентерального и энтерального питания, является на настоящем этапе развития медицины наиболее эффективным методом коррекции расстройств белкового и энергетического обмена. На сегодняшний день в большинстве ретроспективных и проспективных исследований, представленных ESPEN (European Society for Clinical Nutrition and Metabolism, прежнее название - European Society for Parenteral and Enteral Nutrition) и ASPEN (American Society for Parenteral and Enteral Nutrition) убедительно продемонстрирована связь нутритивного статуса пациентов как с непосредственными результатами оперативного лечения – послеоперационными осложнениями и летальностью, так и с затратами на обеспечение лечебного процесса. Еще в 1968 году Комитетом экспертов ВОЗ были приведены факты, подтверждавшие, что послеоперационные осложнения, прежде всего – инфекционные, возникают чаще и протекают значительно тяжелее у лиц с клинически выраженной или субклинической недостаточностью питания и вызывают более серьезные последствия. Уровень послеоперационных осложнений у пациентов с имевшейся нутритивной недостаточностью составил по данным Комитета 31%, в то время как у пациентов с нормальным нутритивным статусом – всего 12%. В анализе, проведенном M. Isabel (2003) и охватывавшем исходы лечения 709 оперированных больных, было показано, что расходы на лечение больных с нутритивной недостаточностью за счет дополнительных затрат на коррекцию осложнений превышали таковые при лечении пациентов с нормальным нутритивным статусом на 308%. Учитывая тот факт, что от 25% до 60% поступающих в хирургические клиники пациентов имеют в различной степени выраженное состояние нутритивной недостаточности, возможно именно целенаправленная нутритивная поддержка способна принципиально улучшить результаты оперативного лечения и вывести хирургию на новый уровень достижений.
Известно, что нутритивная недостаточность наиболее распространена в группах пациентов, оперированных по поводу онкопатологии, у больных, имеющих a priori или в качестве послеоперационного осложнения инфекционный процесс, у пациентов с сопутствующей патологией в виде цирроза печени, тяжелой сердечной недостаточности или хронической обструктивной болезни легких.
В 1986 году, проведя анализ корреляции между нутритивным статусом и результатом лечения после резекции желудка по поводу пептической язвы, H. Stadley установил, что послеоперационная потеря более 20% массы тела соответствует уровню послеоперационной летальности выше 30%, в обратном случае послеоперационная летальность не превышала 4%. По данным А.Л. Костюченко (2005) потеря массы тела на 5% и более в госпитальных больных ведет к увеличению срока госпитализации в 2 раза при увеличении числа осложнений в 3,3 раза. У хирургических пациентов аналогичная потеря массы тела приводит к росту числа осложнений в 6 раз и летальности в 11 раз. Зависимость количества осложнений и уровня летальности от потери массы тела после операции продемонстрировал в 2009 году R. Demling (см. табл. 1).
Таблица 1. Следствия нутритивной недостаточности в послеоперационном периоде (R. Demling, 2009).
Потеря безжировой массы тела | Осложнения | Послеоперационная летальность |
10% | Иммуносупрессия, увеличесние частоты инфекционных осложнений | 10% |
20% | То же + замедление раневой репарации, астенизация | 30% |
30% | То же + невозможность активизации больного, пролежни, пневмония | 50% |
40% | То же + тотальная пневмония, СПОН, сепсис | 100% |
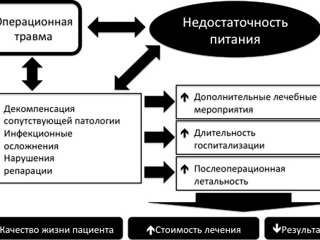
Совершенно иная картина возникает при целенаправленной нутритивной поддержке хирургических пациентов. Исследователи, занимающиеся проблемой нутритивной поддержки в хирургической клинике, единодушны в том, что адекватный нутритивный статус обеспечивает принципиальное снижение числа послеоперационных осложнений (прежде всего – инфекционных) и летальных исходов, создает условия для максимально быстрой активизации пациентов, определяет возможность быстрой репарции раневых дефектов. В конечном счете нутритивная поддержка способствует сокращению срока госпитализации, уменьшает число повторных госпитализаций и улучшаяет качество жизни пациентов. С фармакоэкономической точки зрения некорригированная нутритивная недостаточность приводит к увеличению стоимости лечения на 19,3% при том, что стоимость самой нутритивной поддержки составляет менее 2,5% стоимости лечения осложнений нутритивной недостаточности (T. Amaral, 2007).
Современная концепция «улучшенной послеоперационной реабилитации» (Enhanced recovery after surgery – ERAS), становящаяся все более популярной и направленная на минимизацию времени пребывания пациента в стационаре, рассматривает периоперационную нутритивную поддержку пациента как неотъемлемую составляющую мультимодального «fast track» подхода наряду с лимитированием объема инфузионной терапии, адекватным обезболиванием с применением регионарной анестезии при ограничении введения опиоидных анальгетиков. Одно из средств достижения ранней реабилитации – стремление к восстановлению обычного режима питания и подвижности уже в первые дни послеоперационного периода (см. в разделе 3.4).
Говоря о нутритивной поддержке хирургических больных, следует подчеркнуть, что принципиальных отличий в показаниях к проведению им лечебного питания от пациентов других категорий нет. Стратегическим вектором нутритивной поддержки в хирургической клинике является предупреждение или коррекция нарушений нутритивного статуса пациента, ассоциируемых с изначально имеющимися как следствие основного заболевания, а также закономерно возникающими после операции гиперметаболизмом и катаболизмом. При этом известно, что выраженность катаболических нарушений имеет прямую зависимость с тяжестью основного заболевания и травматичностью оперативного вмешательства. Метаболический стресс, обусловленный активацией симпато-адреналовой системы и выделением колоссального числа биологически активных субстанций (биогенные амины, эйкозаноиды, интерлейкины, свободные радикалы), определяет нарушение всех видов обмена с избыточной мобилизацией энергетических субстратов в процессах гликогенолиза, липолиза, протеолиза и глюконеогенеза, что имеет своим следствием развитие инсулинорезистентной гипергликемии и отрицательного азотистого баланса.
Очевидно, что элементами патогенеза гиперкатаболического состояния и нутритивной недостаточности у пациентов с патологией пищеварительного тракта являются факторы, связанные как с длительной невозможностью адекватного по объему питания per os, так и с развитием локальной и системной воспалительной реакции, а также с проведением травматичных резекционных и восстановительно-реконструктивных оперативных вмешательств и с потенциально возможным развитием послеоперационных осложнений. Дополнительным фактором развития гиперкатаболического состояния может являться опухолевый генез патологического процесса.
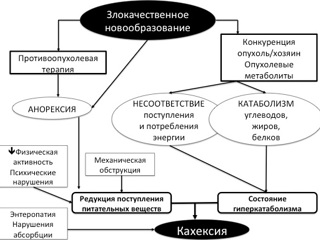
Общеизвестно, что нутритивная поддержка у пациентов, подвергаемых оперативному лечению по поводу злокачественных новообразований, является отдельным лечебным мероприятием, количественные и качественные параметры которого непосредственно влияют на исходы оперативных вмешательств. Очевидная необходимость нутритивной поддержки в онкохирургии объясняется тем, что уже изначально весьма значительная часть пациентов (не менее 50%) поступает в стационар в состоянии сниженного питания, обусловленном как непосредственно онкопроцессом, так и сопутствующими ему нарушениями функции органов пищеварения, что неизбежно имеет место при локализации опухоли на любом уровне пищеварительного тракта. Снижение веса нередко является первым симптомом онкологического заболевания. Степень выраженности нарушения питания зависит от вида первичной опухоли и стадии онкопроцесса; наличие нарушений трофического статуса констатируется у 30 – 80% онкобольных; не менее чем у 15% больных эти нарушения оцениваются как тяжелые. Квинтэссенцией нарушений питания при злокачественных новообразованиях является раковая кахексия, включающая в себя быстропрогрессирующую потерю веса, преимущественно за счет снижения мышечной массы, парадоксальную анорексию, гипо- и диспротеинемию, анемию, отечный синдром, психические расстройства. По мнению экспертов ESPEN (2009) характерная особенность раковой кахексии, как нарушения нутритивного статуса, заключается в сложности или невозможности коррекции имеющихся трофических нарушений стандартной лечебной диетой.
Белково-энергетическая недостаточность у пациентов со злокачественными новообразованиями обусловлена: конкуренцией в системе опухоль/хозяин за энергоносители и пластические субстанции, являющейся следствием депрессивного состояния анорексией, невозможностью приема пищи в полном объеме из-за наличия опухолевой обструкции пищеварительной трубки, изменениями метаболизма, связанными с сопутствующим новообразованиям системным воспалительным процессом, а также нарушением пищеварения и абсорбции на фоне проводимой цитостатической химиотерапии и лучевой терапии, состоянием гиперкатаболизма в ответ на выраженную операционную травму и возможные послеоперационные осложнения.
К патогенетическим особенностям нутритивных нарушений при опухолевом процессе относят вторичную инсулинорезистентность, усиление липолиза, повышение интенсивности окисления жировых субстанций (в том числе и в процессах СРО), высокая интенсивность протеолиза в скелетной мускулатуре и повышенный уровень синтеза белков острой фазы. При этом триггером процессов гиперкатаболизма выступают цитокины, синтезируемые в процессе системной воспалительной реакции.
Известно, что нарушения нутритивного статуса имеют своим следствием снижение выживаемости пациентов как в ближайшем, так и в отдаленном послеоперационном периоде, худший ответ на химиотерапию, принципиально более частое рецидивирование и диссеминацию опухолевого процесса, продолжительную послеоперационную реабилитацию и снижение качества жизни пациентов. При этом объективная сложность коррекции имеющихся нутритивных расстройств связана прежде всего с очевидным ограничением возможностей проведения энтерального (перорального или зондового) питания сообразно потребностям пациента в энергоносителях и пластических субстанциях. Так, по расчетам C. Mariette (2005) в периоперационном периоде энергетические потребности пациента с онкопроцессом составляют 30 – 35 кКал/сут (50-70% потребности в энергии должно обеспечиваться углеводами, 30-50% - липидами). Потребности в экзогенном азоте составляют в предоперационном периоде 0,15 – 0,2 г/кг/сут, в послеоперационном периоде – 0,25 – 0,3 г/кг/сут. Пациент должен получать углеводы в количестве 3 – 4 г/кг/сут, липиды – 1,5 – 2 г/кг/сут. Очевидно, что при наличии функциональных и (или) анатомических нарушений в пищеварительной трубке (опухолевый стеноз, нарушение абсорбции при синдроме короткой кишки, стойкий послеоперационный парез, сложные реконструкции пищеварительной трубки после обширных резекций, высокие тонкокишечные свищи) даже введение сбалансированных энтеральных смесей не в состоянии компенсировать потребности пациента в энергоносителях и пластических субстанциях. В этой ситуации неотъемлемой частью нутритивной поддержки закономерно становится парентеральное питание как в моноварианте, так и в качестве составной части смешанного питания.
Основными задачами нутритивной поддержки вне зависимости от профиля хирургического пациента являются снижение катаболической реакции организма, восполнение энергетических затрат и обеспечение реализации эндогенного пластического потенциала. В зависимости от степени выраженности питательной недостаточности, тяжести метаболических нарушений и от функционального состояния желудочно-кишечного тракта (ЖКТ) нутритивная поддержка может быть реализована путем использования перорального, энтерального зондового питания и парентерального питания по отдельности и, чаще, в комбинации. В большинстве клинических ситуаций эти методы могут использоваться совместно или последовательно, дополняя друг друга. Arvid Wretlind определил «три источника и три составные части» искусственного питания как:
- своевременность – нутритивную поддержку необходимо начинать как можно раньше, еще до развития нутриционных нарушений; нельзя дожидаться развития белково-энергетической недостаточности, поскольку кахексию и гиперметаболизм гораздо проще предупредить, чем лечить;
- оптимальность - искусственное питание необходимо проводить до верифицированной стабилизации нутритивного статуса;
- адекватность – нутритивная поддержка должна отвечать конкретным потребностям конкретного пациента, будучи сбалансирована по составу питательных веществ.
В идеале нутритивная поддержка не должна «догонять уходящий поезд», что нередко происходит при ее назначении уже в условиях клинически манифестированной, а значит - выраженной нутритивной недостаточности. Доказано, что при оперативных вмешательствах с применением традиционной интенсивной терапии (без учета энергетических потерь) в первые недели масса тела снижается на 20% и более. Ясно, что с назначением искусственного питания нельзя медлить, ибо гораздо легче поддерживать нормальный питательный статус, чем восстанавливать нарушенный. Вполне очевидно, что запоздалая компенсация развившихся в послеоперационном периоде нарушений метаболизма изначально менее эффективна и более трудоемка, чем проведение в предоперационном периоде коррекции субклинической и, тем более, явной) нутритивной недостаточности, обусловленной основным заболеванием, а также назначение превентивной нутритивной поддержки уже в первые сутки послеоперационного периода. Многочисленными исследованиями последних десятилетий убедительно показано, что целенаправленная и рутинная оценка нутритивного статуса с целью выявления пациентов с нутритивной недостаточностью и ее коррекция еще до операции, а также компенсация послеоперационного гиперметаболизма пероральным, энтеральным или парентеральным введением энергоносителей и пластических субстанций у ВСЕХ пациентов имеет своим следствием достоверно меньшую частоту локальных и системных послеоперационных осложнений, а, значит, и меньшую послеоперационную летальность, снижение сроков пребывания и в отделении интенсивной терапии, и в стационаре, что, кроме всего прочего, делает лечение экономически более эффективным.
Тем не менее при возникновении целого ряда патологичесих состяний проведение нутритивной поддержки в любом варианте оказывается невозможным: острейшая фаза повреждения (одна из причин, по которой нутритивная поддержка не проводится во время операции), рефрактерный шок, превышение концентрации сывороточного лактата значения 3-4 ммоль/л, наличие гипоксемии с РаО2 меньше 50 мм рт.ст., гиперкапнии с РСО2 более 80 мм рт.ст., ацидоза с рН< 7,2. Однако суммарное количество пациентов с наличием вышеперечисленных признаков (наличие которых, как мы понимаем, требует экстренной коррекции в отделении интенсивной терапии) и несравнимо меньше подавляющего большинства хирургических больных, для которых нутритивная поддержка необходима и возможна.
Собственно нутритивная поддержка в хирургической клинике включает в себя ряд последовательных действий, а именно:
- оценка нутритивного статуса пациента
- определение потребности пациента в энергии, макро- и микронутриентах
- определение пути введения нутриентов (технологии нутритивной поддержки)
- введение питательных субстанций
контроль эффективности и безопасности нутритивной поддержки.
© М.А. Евсеев
27 марта 2016 г.
Ещё больше полезной информации на нашем Телеграм-канале