Отделения
Среди множества патологических процессов наибольший интерес у теоретиков и клиницистов во все времена вызывали те из них, которые чаще всего приводили к гибели или инвалидизации больных. Без преувеличения можно сказать, что самым тяжелым и коварным заболеванием злокачественного генеза у женщин является рак яичников (РЯ). Проблема этой патологии была и остается одной из самых актуальных и трудных разделов онкологии, и поэтому широко обсуждается в различных областях медицины.
Рак яичников наряду со злокачественными опухолями шейки и тела матки является одним из наиболее распространенных заболеваний онкологической природы и в мировой статистике занимает третье место. По данным литературы, карцинома яичников составляет 6-8% из числа всех онкологических заболеваний и 20-25% среди злокачественных опухолей женских половых органов, причем рак яичников составляет около 80% всех опухолей придатков.
По данным международного агентства по изучению рака (МАИР) для большинства стран характерен рост заболеваемости злокачественными опухолями яичников (ЗОЯ). Между тем показатели смертности не имеют тенденции к снижению.
Из числа всей онкогинекологической патологии смертность от РЯ по показателю летальности находится на первом месте , и почти в половине случаев (47%) смертность от рака гениталий обусловлена РЯ. Более того, 2/3 злокачественных опухолей яичников выявляются на поздних стадиях, при переходе патологического процесса за пределы пораженного органа, хотя у 60% больных время от появления первых симптомов до постановки правильного диагноза составляет около 6 мес., у 80% из них уже обнаруживаются метастазы в различные органы. Поздняя диагностика обусловлена отсутствием специфических клинических проявлений на ранних стадиях развития опухолевого процесса, склонностью опухоли яичника к раннему метастазированию, трудностью выявления опухоли при физикальном, рентгенологическом и ультразвуковом исследовании в силу анатомо-топографических особенностей яичников, отсутствием строго детерминированных групп риска, требующих регулярного углубленного обследования. Общая 5-летняя выживаемость этой категории больных в ведущих онкологических центрах не превышает 20-35%.
В настоящее время накоплено значительное количество экспериментальных, эпидемиологических и клинических фактов, позволяющих обозначить многие стороны этиопатогенеза РЯ, несмотря на это причины возникновения большинства опухолей яичников остаются неизвестными. Обзоры многочисленных исследований указывают на высокую частоту рака яичника в индустриальных странах, за исключением Японии. Возможно, это обусловлено диетическими факторами, а именно, высоким потреблением животных жиров, хотя последние исследования не подтверждают связи развития РЯ ни с высококалорийной пищей, ни с употреблением алкоголя, кофеина и никотина. Нет и убедительных доказательств возможного канцерогенного эффекта радиации, применяемой в диагностических и терапевтических целях, в развитии РЯ, хотя в эксперименте моделей опухоли яичника создавали путем облучения грызунов рентгеновскими лучами или при помощи пересадки ткани яичника в селезенку или другие органы портальной системы.
Наибольшая роль в развитии РЯ в настоящее время отводится гормональным и генетическим факторам.
Генетическая предрасположенность выявлена у 1/3 больных РЯ. Предпо-лагается наследование данного заболевания по рецессивному типу консти-туциональных и эндокринно-метаболических особенностей, характерных для РЯ. Наследственные формы РЯ имеют тенденцию скапливаться в семьях – отсюда их рабочее название «семейный рак». Семейный анализ указывает на ассоциацию РЯ с карциномой эндометрия и молочной железы по материнской линии , а по отцовской линии наибольшую опасность представляет рак толстой кишки . По данным мировой литературы семейные формы РЯ могут составлять 10% .
Л.В. Акуленко с соавт. (1998) предложили критерии идентификации наслед-ственных форм РЯ. Таковыми являются:
- наличие в семье 2-х и более родственниц I степени родства (мать и дочь, сестра и сестра) пораженных РЯ и/или раком эндометрия, и/или раком молочной железы;
- пропорция пораженных и непораженных членов семьи (женщин в возрасте 35 лет и старше) должна составлять 33-50%;
- наличие в семье заболевших раком в возрасте 20-49 лет (средний возраст пораженных – 43,0+-2,3г.;
- наличие в семье одного и более больных с первично множественными опухолями разных анатомических локализаций, включая рак органов репро-дуктивной системы;
- наличие в семье одного и более больных с двухсторонним раком молочной железы.
Выделяют три типа семейного ракового синдрома. При первом типе синдрома в нескольких поколениях прослеживается РЯ. Женщины в этих семьях имеют повышенный риск заболевания и другими злокачественными новообразованиями (равном среднему по популяции) . При втором типе синдрома наблюдается симптомокомплекс: яичник – молочная железа. Женщины болеют РЯ и РМЖ в 1,5 раза чаще, чем в общей популяции . Семейный раковый синдром третьего типа – общий раковый синдром ( синдром Линча –ІІ). Женщины и мужчины имеют резко повышенный риск заболевания раком толстой кишки и в меньшей степени аденокарциномами других локализаций.
Одним из важных современных достижений является доказательство генетических повреждений в этиологии РЯ на уровне онкогенов и генов-супрессоров и внедрение этих знаний в клиническую практику. Среди наиболее изученных генных факторов канцерогенеза является активация онкогена К-ras, выявление мутаций в котором может служить для дифференциальной диагностики муцинозного рака яичников. Амплификация с-erbB2\HER2, встречающаяся при РЯ в 10-50% , указывает на неблагоприятный прогноз заболевания. Исследования супрессорного гена р53,отвечающего за апоптоз поврежденных клеток и участвующего в цикле клеточного деления, а также других генов апоптоза, которые инактивируются примерно в половине случаев опухолей яичников пограничной злокачественности, может служить прогностичесикм фактором РЯ. Значительные успехи молекулярной генетики достигнуты в выявлении роли наследственной мутации генов BRCA1, BRCA2, а также MSH2 , MLH1. У носительниц онкогенов BRCA1 , BRCA2 к 60-ти годам частота возникновения РЯ может достигнуть 70%. Таким женщинам строго показана офорэктомия после завершения репродуктивного периода.
Стали классикой исследования по созданию экспериментальных опухолей яичников путем облучения грызунов рентгеновскими лучами и посредством пересадки ткани яичника в селезенку и другие органы портальной сис-темы, которые позволили сформулировать теорию патогенеза с точки зрения нарушения гормонального равновесия в сторону преобладания гонадотропных гормонов. В многочисленных эпидемиологических исследованиях отмечено, что беременность снижает риск РЯ, а большое количество беременностей обладает значительным защитным действием. Бесплодие же повышает риск развития РЯ, а препараты стимулирующие овуляцию в течение более 12 циклов, увеличивают риск в 2-3 раза. В тоже время применение оральных контрацептивов снижает риск развития этого вида рака. В большом исследовании, проводившемся под эгидой ВОЗ, относительный риск развития РЯ у женщин когда-либо принимавших оральные конрацептивы, составил 0,75. Объяснения гормональным факторам можно найти в «овуляторной» гипотезе, постулирующей что риск развития РЯ находится в прямой зависимости от числа овуляторных циклов на протяжении жизни женщины. Покровный эпителий яичника, из которого развивается большинство опухолей яичника, подвергается пролиферации и репарации после каждого овуляторного цикла . Чем больше число овуляций, тем выше потенциальный риск отклонений в репаративных процессах, что ведет к злокачественной трансформации.
Другие патогенетические гипотезы развития РЯ раскрывают иммунологические, биохимические, гистохимические механизмы.
Таким образом, в вопросах этиологии и патогенеза исследователи не всегда приходят к единому мнению, а потому проблема дальнейших эпиде-миологических исследований остается актуальной. Поиск этиологических агентов РЯ, способствующих выделению корректных факторов риска для формирования групп риска и раскрывающих механизмы патогенеза, по-прежнему перспективен.
90% опухолей яичников происходят из целомического эпителия или мезотелия в результате метаплазии мезодермальных клеток. 75% эпителиальных опухолей яичников приходится на долю серозного рака, 20% - муцинозного и 2-3% - эндометриоидного рака. Все остальные формы злокачественных эпителиальных опухолей яичников составляют 3%. Пик заболеваемости раком яичников приходится на возрастной период 55-65 лет. Средний возраст больных эндометриоидным раком яичников примерно на 10 лет ниже, чем у больных муцинозным раком. Серозный рак яичников занимает промежуточную возрастную нишу.
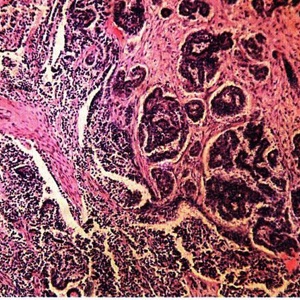
Серозный рак яичников - это опухоль, которая имеет многокамерную кистозную или кистозно-солидную структуру. Клетки опухоли образуют серозную жидкость, аналогичную той, которая секретируется эпителием маточных труб. На ранних стадиях развития поверхность кистозной опухоли гладкая, белесоватого цвета. Серозный рак яичников отличается агрессивным течением. В 50% наблюдений серозный рак поражает оба яичника. Размеры опухоли большие или даже гигантские. Серозный рак яичников может быть высоко-, умеренно- и низкодифференцированным. Опухоль быстро прорастает капсулу, инвазирует в смежные органы и образует множество имплантационных метастазов различных размеров по париетальной и висцеральной брюшине, массивно поражает большой сальник. Асцит образуется у большинства больных.
Муцинозный рак яичников макроскопически - это многокамерная кистозная или кистозно-солидная опухоль, внутренняя капсула которой выстлана слизеобразующим эпителием. В 10-30% наблюдений опухолью поражаются оба яичника. Опухоль может достигать гигантских размеров и развиваться на фоне доброкачественной или пограничной муцинозной кисты. Часто опухоль имеет довольно длинную ножку, которая может перекручиваться. В таких случаях развивается клиника острого живота. Папиллярные разрастания при муцинозных опухолях встречаются реже, чем при серозном раке. У подавляющего большинства больных муцинозным раком опухоль не прорастает капсулу яичников и смежные органы, но имплантационные метастазы по брюшине и большом сальнике образует. Массивный канцероматоз больше характерен для серозного рака. Степень дифференцировки клеток составляющих опухоль может быть различной. При попадании содержимого муцинозной опухоли в брюшную полость может развиться псевдомиксома брюшины. В таком случае брюшная полость может содержать громадное количество слизистого содержимого с формированием множества участков спресовавшегося муцина , сдавливающего органы брюшной полости.
Ведущие клинические симптомы распространенных форм рака яичников обусловлены размерами первичных опухолей, инвазивным ростом в смежные органы и массивным имплантированием опухолевых клеток в различные анатомические структуры брюшной полости. Вторым по клинической значимости путем распространения рака яичников является лимфогенное метастазирование опухоли. В первую очередь лимфогенными метастазами поражаются поясничные лимфатические узлы, затем подвздошные и обтураторные. Нередко, при III - IV стадиях рака яичников можно наблюдать метастазы опухоли в лимфатические узлы надключичной области, шеи и паховой зоны. Уже при I клинической стадии рака яичников лимфогенные метастазы в поясничные группы лимфатических узлов составляют 18%, при II - 20%, III -42%, IV стадии - 67% наблюдений. Гематогенное метастазирование опухоли как правило реализуется вслед за имплантационным и лимфогенным, когда имеется значительное распространение опухоли. Наиболее часто отдаленные метастазы наблюдаются в печени и легких. Для рака яичников характерны метастатические плевриты.
На ранних стадиях развития рак яичников протекает бессимптомно. Рак яичников I и даже II клинических стадий в большинстве наблюдений является случайной находкой при различных хирургических вмешательствах на органах брюшной полости и обследований, проводимых по поводу гинекологической или экстрагенитальной патологии. Жалобы больных отражают уже значительное распространение процесса: увеличение живота, боли, нарушение менструальной функции или функции смежных органов малого таза, одышку. Иногда больные обнаруживают объемное образование в брюшной полости, отмечают снижение веса, повышение температуры, снижение аппетита, увеличение периферических лимфатических узлов.
Диагностика распространенных форм рака яичников несложна. Бимануальное ректовагинальное исследование позволяет у подавляющего большинства больных выявить объемное образование в малом тазу. Верхний полюс опухоли может пальпироваться в гипо- или мезогастральной области, нижний - в дугласовом пространстве. Часто в малом тазу определяется единый опухолевый конгломерат, включающий в себя внутренние гениталии, часть толстой и петли тонкой кишки. При незначительном количестве асцитической жидкости, можно пальпировать метастатически измененный большой сальник. Цитологическое исследование асцитической жидкости или экссудата из плевральной полости позволяет верифицировать диагноз. Высокоинформативными методами диагностики злокачественных эпителиальных опухолей яичников являются ультразвуковое исследование и определение уровня опухолевых маркеров - антигенов СА-125, СА 19-9, НЕ4 в сыворотке крови. Установить распространенность злокачественного процесса позволяют рентгенологическое исследование органов грудной полости, колоноскопия, гастроскопия, ирригоскопия, цисто- и ректороманоскопия. При необходимости выполняются радиоизотопная ренография, экскреторная урография, компьютерная томография, лапароскопия.
Диагностика рака яичников в начальной фазе его развития затруднительна. При гинекологическом обследовании выявляются односторонние, реже двухсторонние образования, которые у женщин репродуктивного периода жизни следует дифференцировать, прежде всего, с функциональными кистами, псевдоопухолями воспалительного генеза, эндометриозом, миомой.
У женщин пременопаузального и постменопаузального периодов жизни выявление придаткового образования 2 см и более практически всегда требует хирургического вмешательства. Дифферециальный диагноз проводится с доброкачественными опухолями яичников, миомой матки и метастатическими поражениями яичников при раке желудка, толстой кишки и молочной железы. Окончательный диагноз устанавливается при диагностической лапароскопии с обязательным интраоперационным гистологическим исследованием.
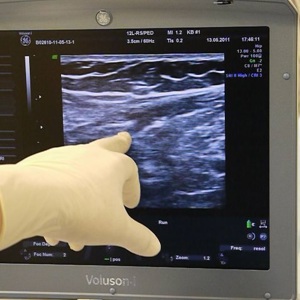
Ранняя диагностика РЯ остается главной нерешенной проблемой в онкогинекологии. Клиническое ректо-вагинальное обследование малого таза нередко позволяет идентифицировать новообразование яичников. С 1970-х годов благодаря внедрению ультразвуковых технологий наступила новая эра в диагностике опухолей яичника. Ультразвуковое исследование малого таза стало рутинным методом в обследовании пациентки при подозрение на опухоль яичника. При небольших новообразованиях в малом тазу наибольшей информативностью обладает трансвлагалищная эхография, при образованиях более 6-7 см возрастает роль трансабдоминальной эхографии. Рак яичника на ранних стадиях эхографически представляет собой кистозное образование с единичными сосочковыми образованиями с нечеткими контурами, тогда как при 1С и ІІ стадиях уже визуадизируются обширные папиллярные разрастания с нарушением целостности капсулы кисты и в позадиматочном пространстве определяется небольшое количество жидкости. Для генерализованных стадий РЯ эхографически характерно наличие неправильной формы опухолевого конгломерата кистозно-солидного строения с размытыми границами разрастаниями по наружному контуру. Асцит выявляется в 70-80% набдюдений. При выявлении эхографических признаков злокачественности опухолевого процесса в яичниках и за их пределами необходимо дифференцировать первичность и вторичность поражения яичников.
Достоинствами ультразвукового метода в диагностике опухолей яичников являются его высокая информативность, простота, быстрота, безвредность, безболезненность, возможность объективного документирования и многократного проведения.
В качестве следующего этапа углубленной диагностики РЯ может быть названа компьютерная томография, магнитно – резонансная томография в случаях, когда эхография не дает четкого представления о степени опухолевого поражения.
Большое значение в диагностике РЯ отводится поиску опухолевых маркеров- специфических биологических веществ, продуцируемых опухолью, которые можно было определить биохимическими или иммунологическими методами. Наиболее известны в настоящее время две группы опухолевых маркеров: онкофетальные антигены (альфа-фетопротеин и хорионический гонадотропин) и опухоль-ассоциированные антигены (СА-125,СА-19-9 и СА-72-4, НЕ4).
Определение онкофетальных антигенов в крови у молодых пациенток с опухолевыми образованиями солидного строения в яичниках указывает на наличие герминогенной опухоли. Определение уровня онкофетальных антигенов в процессе лечения и после его окончания позволяет судить об эффективности терапии. Из опухоль-ассоциированных антигенов наиболее изучен СА-125. Данный опухолевый маркер представляет собой гликопротеиновый антиген, вырабатываемый клетками серозных злокачественных опухолей яичников и определяемый с помощью моноклональных антител. СА-125 не является строго специфичным только для РЯ , его уровень может быть повышен при циррозе печени, остром панкреатите, эндометриозе, миоме матки и беременности. У молодых женщин его концентрация в течение менструального цикла также может колебаться. Однако содержание СА-125 свыше 35 Е\мл определяется почти у 80 % больных РЯ: у 90 % с распространенным РЯ и у 50 % с ранними стадиями. Это значительно чаще, чем при неопухолевых патологических состояниях ( в 5-10 %) или у здоровых женщин ( до 1 %). Поэтому СА-125 является стандартом в обследовании женщин при обнаружении опухолевых масс в малом тазу, подозрительных по данным клинико-эхографических исследований на рак. При этом возможность получения ложноположительных результатов среди здорового контингента обследуемых не позволяет использовать СА -125 как опухолевый маркер для скрининговых программ с целью раннего выявления рака яичников. Наибольшее значение приобретает определение уровня СА-125 в динамике проведения лечения рака и в дальнейшем мониторинге за больными для выявления рецидивов заболевания.
Одним из наиболее важных моментов, влияющих на планирование лечения является установка стадии заболевания.
В СССР до 1985 г., наряду с постоянно совершенствующимися классифи¬кациями FIGO (1964, 1970, 1976, 1985) и TNM (1954, 1967, 1970, 1981, 1987, 1992) использовалась классификация Минздрава СССР 1956 г., по которой к I стадии относилось поражение только одного яичника, ко II стадии - переход на другие гениталии, к III стадии - диссеминация париетальной брюшины малого таза, во¬влечение в опухолевый процесс региональных лимфатических узлов и большого сальника. К IV стадии на ряду с прорастанием соседних органов, отдаленных ме¬тастазов, относились все асцитические формы и случаи с поражением брюшины за пределами малого таза . Только широкое развитие химиоте¬рапии, способной в значительной степени повлиять на состояние внутрибрюшинных метастазов позволило отказаться от прежнего стадирования РЯ и перейти к современным классификациям FIGO и TNM . Тем не менее, до сих пор все клинические классификации РЯ остаются достаточно условными. Можно выделить истинно локализованную стадию, при которой очаг ограничен одним яичником, без повреждения капсулы, а пятилетняя выживаемость больных этой группы достигает 90%, с которой согласны все со¬временные авторы, и вторую, когда процесс вышел за пределы яичника, тем са¬мым приобрел системный характер. Даже при диагностированных "ранних" ста¬диях РЯ по современным классификациям, скрытые метастазы по брюшине или в лимфатических узлах снижают пятилетние показатели до 70-40% . Пятилетние результаты при Шс и IV ста¬диях по данным литературы не превышают 10% несмотря на прогресс в лечении.
При раке яичников различают пять типов хирургических вмешательств:
- Первичная циторедуктивная операция заключается в удалении возможно большого объема первичной опухоли и ее метастазов. Оптимальный объем этой операции-отсутствие визуальных признаков опухоли или минимальная остаточная опухоль.
- Промежуточная циторедуктивная операция. Выполняется при распространенном раке яичников после 2 курсов химиотерапии, с целью уменьшения размеров первичной опухоли и ее метастазов. Цель хирургического вмешательства заключается в максимально возможном удалении опухолевых масс для создания наиболее благоприятных условий последующей химиотерапии.
- Вторичная циторедуктивная операция. Операция выполняется больным раком яичников, которым проведено комбинированное лечение, но имеется остаточная опухоль или локализованная рецидивная опухоль размерами более 5 см.
- Операция “second-look”. Диагностическая лапаротомия, которая выполняется клинически излеченным больным раком яичников с нормальными показателями СА-125 и отсутствии ультразвуковых и рентгенологических признаков заболевания. Смысловая значимость этой операции состоит в морфологическом подтверждении излеченности больной и определении дальнейшей тактики ведения.
- Паллиативная повторная операция. Производится по экстренным или срочным показаниям у больных с прогрессированием заболевания в связи с внутрибрюшным кровотечением, кишечной непроходимостью, перитонитом. Цель операции — устранить причину острого живота (удаление распадающейся опухоли, остановка кровотечения, резекция блокированной или перфорированной опухолью части кишки)
При ранних стадиях РЯ, к которым относят la, Ib и Па, в качестве хирургиче¬ского этапа лечения необходимо выполнять пангистерэкгомию с экстирпацией боль¬шого сальника на уровне поперечно-ободочной кишки. Для обоснования ранней ста¬дии, обязательно производится цитологическое исследование перитонеальной жидко¬сти, при её наличии, смывов с брюшины малого таза, боковых карманов брюшной полости, печени и диафрагмы. При низкодифференцированных опухолях необходима биопсия тазовых и парааортальных лимфоузлов. У молодых женщин с высокодиффе¬ренцированным раком яичников или опухолями пограничной злокачественности, при желании пациентки сохранить детородную функцию, возможен органосохраняющий объем операции: односторонняя аднексэктомия с обязательной резекцией второго яичника, оментэктомией и цитологическим контролем. В подобных наблюдениях, которые чрезвычайно редки, после родов выполняют экстирпацию матки с оставшимися придатками. Следует помнить, что органосохраняющие операции при раке яичников — это исключение, а не правило.
При подтверждении ранней стадии РЯ, адьювантная химиотерапия может не выполняться в случаях пограничной злокачественности и при высокодифференциро¬ванном раке. В остальных случаях рекомендована комбинированная химиотерапия в количестве 4-6 циклов препаратами платины с алкилирующими агентами. Примене¬ние таксанов и антрациклинов при индукционной химиотерапии при ранних стадиях РЯ остается дискуссионным. Эффективность таких методов, как лучевая терапия и гормональное лечение при ранних стадиях РЯ не доказана.
При местно-распространенном и диссеминированном процессе, к которому ряд авторов причисляет и 1с стадию, в связи с наличием опухолевых клеток по брюшине, хирургическое вмешательство всегда должно быть этапом комплексно-го лечения и носить циторедуктивный характер. Оптимальной циторедуктивной операцией считается субтотальная гистераднексэктомия или пангистерэктомия с экстирпацией большого сальника, с уменьшением остаточных опухолевых масс, по мнению разных авторов, от 0,5 до 2 см3. Только оптимальная циторедукция может быть основанием для постановки ШЬ стадии, при которой отдаленные ре-зультаты заметно лучше, по сравнению с Шс стадией, в которой к сожалению, на¬ходится более половины больных, получивших комплексное лечение. В повседневной клинической практике встречают ситуации, когда полное удаление опухоли невозможно. Массивный канцероматоз, тотально замещенный опухолью “панцирный” большой сальник, прорастание опухоли в диафрагму, ворота печени и ее паренхиму, малый сальник, брыжейку тонкой кишки, забрюшинные пространства часто вынуждают хирурга минимизировать объем хирургического вмешательства. Вместе с тем, всегда следует стремиться к удалению первичной опухоли, большей части сальника и крупных опухолевых узлов на париетальной брюшине.
При Шс стадии объем вмешательства может быть уменьшен только из-за невозможности удаления масс опухоли без повреждения жизненноважных органов. Удаление лимфатических узлов забрюшинного пространства при РЯ, по мнению многих хирургов, носит диагностический характер. Дополнение операции аппендэктомией, спленэктомией, удалением пораженных отделов кишки, может проводиться только с целью достижения условной радикальности операции. Паллиативные вмешательства при нарастании кишечной непроходимости производятся с целью улучшения качества жизни больных. При массивных отдаленных метастазах в пе¬чень и легкие циторедуктивное вмешательство не показано. В свою очередь, около 10% больных раком яичников при первичном обращении оперировать не представляется возможным. Основными причинами подобных клинических ситуаций являются прорастание первичной опухоли в смежные органы и мягкие ткани малого таза, тотальный канцероматоз и множественные метастазы в органы брюшной полости, асцит, плевриты, отягощенное соматическое состояние, пожилой и старческий возраст, резко ослабленное состояние больных. Лечение этой категории больных начинается с системной полихимиотерапии. В результате короткого курса индукционной химиотерапии (2-4 цикла) примерно 30% больных представляется возможным выполнить промежуточную циторедуктивную операцию. Операция предпринимается с целью уменьшения массы первичной опухоли и ее метастазов и, таким образом, повысить эффективность последующей химиотерапии, а также улучшить качество жизни больных. Доказано, что промежуточная циторедуктивная операция повышает выживаемость больных раком яичников.
Системная химиотерапия при местно-распространенной и метастатической формах РЯ является обязательным компонентом лечения, в количестве не менее 6 курсов. При неэффективности химиотерапии первой линии возможен переход на другие группы препаратов. Выбор вариантов химиотерапии не является задачей популяционных исследований при РЯ.
Ожидалось, что широкое внедрение новейших химиотерапевтических пре- паратов, таких как таксол, гемзар и др. должно увеличить медиану выживаемости больных РЯ на 12 мес. Однако до сих пор остается открытым вопрос об эффек- тивности таксанов в качестве химиотерапии первой линии, так как международ- ные клинические исследования Гинекологической онкологической группы - GOG-111, GOG-132, ICON-3 - дают противоречивые результаты о их преимуществе по сравнению с платиносодержащей комбинированной химиотерапией.
Вопрос о показаниях к лучевой терапии при распространенных формах РЯостается открытым .
Несмотря на разработанные стандарты, до сих пор поднимаются вопросы по оптимизации лечения РЯ, такие как: 1. Роль органосохраняющих операций и адъювантной химиотерапии при доказанных ранних стадиях РЯ. 2. Место лим-фаденэктомии в лечении РЯ. 3. Роль неоадьювантной химиотерапии и рацио-нальное число циклов химиотерапии перед попыткой циторедуктивной операции. 4. Значение чрезмерного радикализма при проведении хирургического этапа лече¬ния. 5. Роль повторных хирургических вмешательств после окончания первой ли¬нии химиотерапии.
Прогноз больных раком яичников зависит, прежде всего, стадии заболевания (распространенности процесса), гистологического строения опухоли и плоидности опухолевых клеток. Далее следуют: степень дифференцировки клеток опухоли, экспрессия онкогена HER-2/neu, скорость размножения опухоли, размеры остаточной опухоли после хирургического вмешательства, выраженность асцита и возраст больной. Наиболее неблагоприятным прогнозом отмечаются больные с массивными диссеминированными формами злокачественных эпителиальных опухолей яичников. Полисерозиты и отдаленные метастазы у больных пожилого и старческого возраста, у которых верифицирован светлоклеточный или низкодифференцированный серозный рак с анэуплоидией клеток опухоли сводят шансы на излечение больной практически к нулю. В то время, как высокодифференцированные злокачественные опухоли яичников любого гистологического строения IА и IВ стадий излечиваются в 95-100% наблюдений. Приведенные факторы прогноза у больных запущенными формами рака яичников в связи с массивным распространением и большим суммарным объемом опухоли существенного прогностического значения не имеют, а любые методы лечения носят лишь паллиативный характер.