Целью настоящего исследования явилось определение характера и особенностей нутриционной поддержки при хирургическом лечении больных с постгастрорезекционными и постгастрэктомическими синдромами. В работе анализируются результаты оценки трофологического статуса 68 больных, перенесших резекционные вмешательства на желудке. Отмечено, что у 26,5% больных с клиническими проявлениями болезней оперированного желудка возникают декомпенсированные формы расстройств обмена веществ и трофики, влекущие множественные нарушения гомеостаза и требующие выполнения реконструктивных хирургических вмешательств. Изучены результаты выполнения реконструктивных операций с формированием функционально активных жомно-клапанных соустий у 18 пациентов, страдающих болезнью оперированного желудка. Доказано, что проведение аргументированной нутриционной поддержки в периоперационный период позволяет избежать грубых нарушений метаболизма и обеспечивает достаточно хорошую компенсацию функции пищеварения, значительно повышая качество жизни данной категории больных. Ключевые слова: нутриционная поддержка, реконструктивные операции на желудке.
Введение. Почти одновременно с внедрением в клиническую практику операций на желудке возникла новая глава в хирургической гастроэнтерологии о своеобразных состояниях, свя¬занных с произведенной операцией. Наиболее часто среди болезней оперированного желудка встречаются рефлюкс-эзофагит, рефлюкс-гастрит, пептические язвы гастроэнтероанастомоза, демпинг-синдром и синдром приводящей петли как результат новых топографо-анатомических соотношений органов пищеварения, разрушения естественных сдерживающих и антирефлюксных механизмов пилорического жома и эзофагокардиального перехода, утраты резервуарной функции желудка и заброса кишечного содержимого в вышележащие отделы желудочно-кишечного тракта [1-4]. При этом практически у всех пациентов на фоне клинических проявлений болезни оперированного желудка регистрируются выраженные расстройства обмена веществ и трофики (декомпенсированные формы белково-энергетической недостаточности), приводящие к нарушению гомеостаза, зачастую обосновывающие необходимость выполнения реконструктивных хирургических вмешательств [5, 6].
Целью настоящего исследования явилось определение характера и особенностей нутриционной поддержки при хирургическом лечении больных с постгастрорезекционными и постгастрэктомическими синдромами.
Материал и методы: В исследование включены 68 больных, перенесших резекционные вмешательства на желудке. 53 мужчины и 15 женщин. Средний возраст составил 49,3±41 лет. У 18 (26,5%) обследованных было диагностировано тяжелое течение постгастрорезекционных и постгастрэктомических синдромов: 16 больным ранее была выполнена дистальная резекция желудка по Billroth-II в модификации Hofmeister-Finsterer по поводу осложненных гастродуоденальных язв, у 2 – гастрэктомия с формированием эзофагоеюноанастомоза по принципу Billroth-II с абдоминальной лимфодиссекцией (D2) по поводу рака желудка. Сроки выполнения реконструктивных вмешательств относительно первичной операции варьировали от 10 месяцев до 7,1 лет (2,2±0,4 лет).
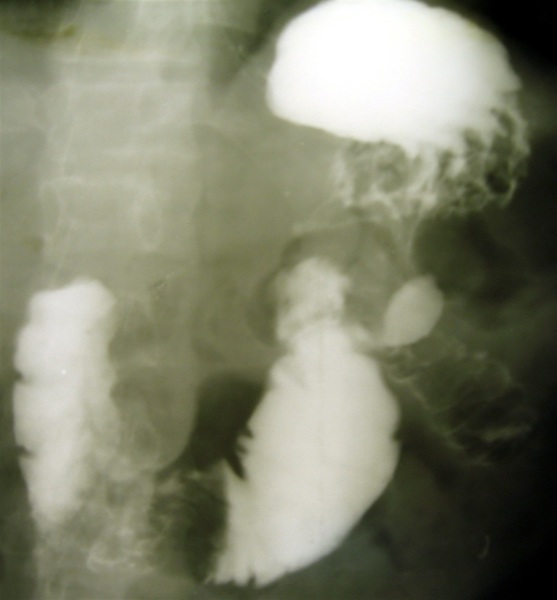
Показаниями для выполнения реконструктивных операций в 11 случаях явились пептические язвы гастроэнтероанастомоза или начального отдела отводящей петли, осложненные пенетрацией в окружающие органы (9) и острым желудочно-кишечным кровотечением (2), в большинстве случаев сочетавшиеся с выраженным энтерогастроэзофагеальным рефлюксом (9) и демпинг-синдромом (3). У 7 больных превалировал демпинг-синдром, сочетающийся с рефлюксными осложнениями (6) и в одном случае синдром приводящей петли (рис. 1).
С целью хирургической коррекции постгастрорезекционных и постгастрэктомических синдромов были разработаны способы реконструктивных операций, позволяющих максимально восстановить утраченные функции верхних отделов пищеварительного тракта. Основой для выбора способа реконструктивных операций явились работы проф. Г.К. Жерлова по формированию функционально активных жомно-клапанных соустий [4].
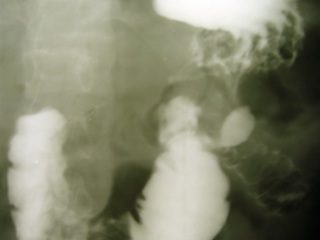
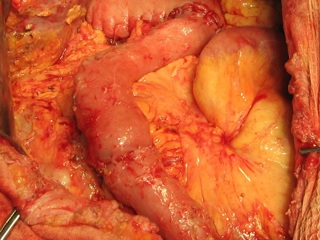
Больным с постгастрорезекционными синдромами проводили ререзекцию культи желудка по Roux с коррекцией эзофагокардиального перехода и созданием сдерживающего механизма в отводящей петле тонкой кишки посредством формирования инвагинационного клапана (рис. 2). Больным, перенесшим гастрэктомию, резецировали приводящую петлю тонкой кишки от межкишечного до пищеводно-кишечного соустья с последующим формированием антирефлюксного механизма эзофагоеюноанастомоза и инвагинационного клапана в отводящей петле тонкой кишки [7].
В качестве симультанных вмешательств 4 больным была выполнена холецистэктомия по поводу желчнокаменной болезни, хронического калькулезного холецистита; одному больному – герниопластика по поводу послеоперационной вентральной грыжи.
Всем больным проводили оценку клинических и лабораторных критериев, эндоскопическое исследование и изучение моторно-эвакуаторной функции верхних отделов желудочно-кишечного тракта в ходе полипозиционного рентгенологического исследования и трансабдоминальной ультрасонографии. Нутритивный статус оценивался по критериям алиментационно-волемического диагноза [5, 8, 9]. Качество жизни больных определяли с помощью специализированного опросника Gastrointestinal Quality of Life Index (E. Eypasch, 1995).
Результаты и обсуждение: У 53 (77,9%) больных после операций на желудке отмечалась трофологическая недостаточность, в частности, при субтотальной резекции желудка и гастрэктомии в промежуток от 1 года до 5 лет – у 10,3% пациентов наблюдалась I степень, у 4,4% и 11,8% – II и III степень соответственно. В сроки более 5 лет после операции I степень трофологической недостаточности не диагностирована ни в одном случае, II степень – у 5,9%, III степень – у 4,4% пациентов.
После экономной дистальной резекции желудка в сроки от 1 года до 5 лет I степень трофологической недостаточности наблюдалась у 16,2% пациентов, II степень – у 7,4%, III степень – у 8,8%, а в сроки более 5 лет I, II и III степень диагностирована в 2,9%, 4,4% и 1,5% случаев соответственно.
Таким образом, развитие клинически значимой трофологической недостаточности наблюдалось у 33 (48,5%) больных, причем у 18 (26,5%) возникли декомпенсированные формы расстройств обмена веществ. Наибольшие трофологические нарушения и выраженный синдром мальабсорбции был связан с выключением двенадцатиперстной кишки из пассажа пищи. При этом более глубокие нарушения белкового, микроэлементного, витаминного и других видов обмена развивались преимущественно после обширных резекций желудка и гастрэктомий.
Анализируя причины и характер трофологических расстройств, следует отметить, что в отличие от пилоруссохраняющих и пилорусмоделирующих вмешательств, классические варианты резекции и экстирпации желудка в большинстве случаев сопровождаются грубыми двигательными расстройствами с невозможностью сохранения порционного поступления пищи в кишку. Следует отметить, что в естественных условиях пищеварения (в норме) в тонкую кишку поступают уже частично подготовленные пищевые частицы. Олигомеры (ди-, трипептиды и другие), образовавшиеся за счёт полостного гидролиза, подвергаются в кишечнике дальнейшему расщеплению до мономеров, способных к всасыванию энтероцитами и поступлению в кровь. Вследствие оперативного вмешательства отмечается поступление в кишку полимерных соединений, что напрягает системы полостного гетерофазного и пристеночного пищеварения, снижает возможность всасывания, формируя в итоге предпосылки к развитию трофологической недостаточности.
Резекции желудка оказывают существенное влияние на электрическую, всасывательную и секреторную активность кишечника, в частности, снижается секреция энтерокиназы и щелочной фосфатазы, холецистокинина и секретина, нарушается цикл энтерогепатической циркуляции желчных кислот, происходят ультраструктурные изменения энтероцитов, что также является морфологической основой развития энтеральной недостаточности.
Кроме того, операции на желудке оказывают значительное влияние на внешнесекреторную и эндокринную функции поджелудочной железы, что проявляется асинхронной панкреатической моторикой в виде нарушения скорости продвижения химуса и экзокринного секрета по кишке, неадекватного перемешивания химуса с панкреатическим соком и желчью, формируя панкреатогенный компонент постгастрорезекционной трофической недостаточности.
Таким образом, одной из основных задач предоперационной подготовки больных к выполнению реконструктивных операций является выполнение адекватной нутриционной поддержки с целью снижения риска прогрессирования метаболических осложнений в послеоперационном периоде.
При трофологической недостаточности I-II степени и сохранённой или частично угнетённой функции желудочно-кишечного тракта (по параметрам алиментационно-волемического диагноза) ограничивались сипинговой коррекцией. При III степени трофологической недостаточности и II степени кишечной недостаточности дополнительно использовали сочетанную парентеральную и сипинговую нутриционную коррекцию составами, близкими к химусу (т.е. частично расщеплёнными), до восстановления метаболических норм. При III степени трофологической недостаточности и выраженной кишечной недостаточности применяли парентерально-энтеральное лечение в соответствии с синдромными нарушениями до восстановления метаболических констант.
Ранний послеоперационный период после реконструктивных вмешательств включал в себя постоянную декомпрессию верхних отделов желудочно-кишечного тракта в течение первых трех-четырех суток, энтеральное зондовое питание, раннюю активизацию больных, коррекцию водно-электролитных нарушений, профилактику развития осложнений общехирургического профиля. Особенностью нутриционной поддержки в эти сроки явилось применение фармаконутриентов, по составу максимально приближённым к химусу, что способствовало более быстрому восстановлению моторно-эвакуаторной активности верхних отделов желудочно-кишечного тракта. Использовались химусоподобные составы типа Нутрихим, Ренутрил под обязательным прикрытием прокинетиков. В дальнейшем назначали дробный (6-7 раз в сутки) прием теплых специализированных смесей в виде сипинга с постепенным переходом на неадаптированную пищу.
Летальных исходов и специфических послеоперационных осложнений отмечено не было. Ранние осложнения общехирургического характера возникли у одного больного и были связаны с развитием острого панкреатита, купированного посредством проведения консервативной терапии. Послеоперационный койко-день в среднем составил 11,3±2,17.
В ближайший послеоперационный период 15 больных оценили результаты лечения как «хорошие» и «отличные». Удовлетворительный результат коррекции постгастрэктомических расстройств констатирован у 2 больных и был связан с сохранением клинических проявлений демпинг-синдрома, корригирующегося соблюдением диеты. В одном случае был выявлен рецидив пептической язвы отводящей кишки при нормальной концентрации гастрина в плазме крови, что было расценено как неудовлетворительный результат ререзекции желудка, потребовавший в дальнейшем проведения противоязвенной терапии.
В отдаленные сроки после операции признаков выраженных моторно-эвакуаторных расстройств верхних отделов желудочно-кишечного тракта отмечено не было. Сформированные при выполнении реконструктивных вмешательств антирефлюксные и сдерживающие механизмы обладали хорошей функциональной активностью. Сравнение уровня качества жизни пациентов до и после выполнения реконструктивных операций показало высокую эффективность разработанных хирургических технологий.
Таким образом, полученные результаты свидетельствуют, что длительное и тяжелое течение заболевания, а нередко неоднократные безуспешные оперативные вмешательства на верхних отделах желудочно-кишечного тракта, приводят к развитию выраженных метаболических расстройств. С помощью разработанных функции-восстанавливающих операций удалось избавить подавляющее большинство пациентов от клинических проявлений болезней оперированного желудка. Нутритивная коррекция трофологичекого статуса в пред- и в раннем послеоперационном периоде является неотъемлемым компонентом хирургического лечения больных с постгастрорезекционными и постгастрэктомическими синдромами, способствует профилактике метаболических осложнений и приносит ожидаемый реабилитационный успех, обеспечивая высокий уровень качества жизни оперированных.
Выводы:
1. У 26,5% больных с постгастрорезекционными и постгастрэктомическими синдромами возникают декомпенсированные формы расстройств обмена веществ и трофики, влекущие множественные нарушения гомеостаза и требующие, наряду с выраженными клиническими проявлениями болезни оперированного желудка, выполнения реконструктивных хирургических вмешательств.
2. Использование методов функциональной хирургии при выполнении реконструктивных операций позволяет в большинстве случаев компенсировать утрату резервуарной функции желудка и обеспечить профилактику заброса кишечного содержимого в вышележащие отделы желудочно-кишечного тракта, тем самым в значительной мере купировать основные проявления болезни оперированного желудка.
3. Нутриционная поддержка при хирургической коррекции постгастрорезекционных и постгастрэктомических синдромов, как предоперационная подготовка и неотъемлемая составляющая раннего послеоперационного периода, позволяет избежать грубых нарушений метаболизма и обеспечивает достаточно хорошую компенсацию функции пищеварения, значительно повышая качество жизни данной категории больных.
12 июля 2013 г.
Ещё больше полезной информации на нашем Телеграм-канале